Bonjour (ou bonsoir) !
Quelques questions concernant l'étude d'un protocole expérimental restent pour moi un mystère.
Voici le protocole:
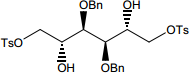
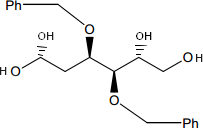
Une solution contenant 180 mmol de chlorure de tosyle (chlorure de paratoluènesulfonyle Ts-Cl) dans 100 mL de pyridine est additionnée lentement, à 0°C et sous forte agitation, sur une solution de tétrol D (90 mmol) dissous préalablement dans 100 mL de pyridine.
(La réaction est suivie par chromatographie sur couche mince de silice, en utilisant un mélange d’acétate d’éthyle et de cyclohexane en proportion 60/40 comme éluant. Le rapport frontal Rf du produit final ditosylé E est de 0,45 dans ces conditions, alors que celui du produit intermédiaire monotosylé E' est de 0,10.)
La réaction est poursuivie jusqu’à disparition complète du produit monotosylé, après environ 20 h de réaction.
Le mélange réactionnel est alors versé sur 700 mL de solution glacée d’acide chlorhydrique à 6 mol.L–1, puis extrait deux fois avec 400 mL d’éther.
Les phases organiques sont rassemblées, lavées par une solution aqueuse saturée d’hydrogénocarbonate de sodium (NaHCO3), puis séchées sur sulfate de magnésium anhydre.
Après filtration et évaporation du solvant sous pression réduite, on isole 79 mmol de composé E sous forme de cristaux blancs, de pureté suffisante .
Ts-Cl :chlorure tosyle.png
D:d.png
E: E.png
E': E'.png
Questions:
1) Quel est le but du traitement du mélange réactionnel par l’acide chlorhydrique ? Préciser le contenu de chaque phase lors de l’extraction à l’éther.
2) Quel est le but du lavage de la phase organique par la solution d’hydrogénocarbonate de sodium ? Pourquoi ne pas utiliser une solution d’hydroxyde de sodium ?
Je suppose que le rôle du HCl est de neutraliser la pyridine, mais pour le reste, je suis sans réponses
Merci d'avance si vous m'éclairez un peu ;]
-----




 )
)