Bonjour (ou bonsoir)!
Je rencontre quelques difficulté à résoudre l'exercice un peu long que voici:
Enoncé
La solubilité du diiode solide dans l'eau pure vaut s=1,40.10-3 mol/L à 298K.
On utilise un excès d'ion iodure pour augmenter s. S'établit l'équilibre de complexation: I2(aq)+I-(aq)=I3-(aq) de constante d'équilibre K°= 460 à 298K
Exprimer la solubilité du diiode en fonction des espèces solubles et calculer sa valeur pour une solution contenant initialement 0,300 mol/L en iodure de potassium.
Mon raisonnement:
J'ai pensé à utiliser la formule de la constante K°=[I3-]/([I2][I-])
Puis à remplacer [I2] par s mais je ne pense pas que [I2]eq=s...
Ou encore à faire le tableau d'avancement avec [I2] initial = s et [I-] initial = 0,3 mol/L,
dans ce cas: K°= x / (0,3-x)(s-x) <=> s= x + (x/(0,3-x)K°) avec x, l'avancement volumique
Mais comme s limitant, alors x=s, mais je ne pense pas que ce soit bon non plus...
Suite énoncé:
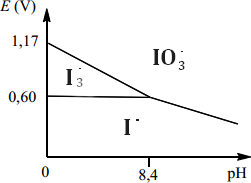
Voici l'allure de diagramme E-pH de l'élement iode:
Chaque espèce dissoute à une concentration égale à 10-1 mol/L sur une frontière.
Retrouver la pente théorique de la frontière entre IO3- et I-.
Données: E°(I3-/I-)=0,54 V E°(IO3-/I3-)=0,17 V
(RT/F)ln10 = 0,06 V à 25°C
Mon raisonnement:
On voit sur la courbe que pour pH 8,4, E=O,6 sur la frontière
On commence par chercher E° du couple de demi redox: IO3- + 6H+ + e- =I- + 3H2O
On utilise la formule de E°':
E°'= E°+ (0,06/6) log h6 = E°-0,01*6*pH =E°-0,504
Or E=E°'+(0,06/n) log Q
On sait qu'à la frontière [I-]=[IO3-]=10-1 mol/L
Donc 0,6= E° - 0,504 + (0,06/6) log(10-1/10-1)
<=> E°= 0,6-0,504
<=> E°= 1,1 V
On connait desormais 2 points de la droite: (0;1,1) et (0,6;8,4)
p=0,6/ (8,4-1,1)= 0,082
Est-ce bon ?
Suite énoncé:
On réalise un dosage retour, dont voici le protocole expérimental :
Étape n°1 :
Dans un volume V1 = 20,0 mL de solution d’iodate de potassium (KIO3) de concentration C1 = 1,50.10–2 mol/L, on ajoute un large excès d’iodure de potassium KI, puis quelques mL d’acide sulfurique concentré. On observe une coloration brune intense.
Étape n°2 :
On y introduit alors m0 = 1,20 g de solution commerciale pour « permanente » à froid contenant l’acide thioglycolique HS-CH2-COOH. On laisse sous agitation pendant quelques min.
Étape n°3 :
On effectue le titrage de la solution résultante par une solution de thiosulfate de sodium (noté R-S-) à C2 = 0,100 mol/L en présence d’empois d’amidon. Le virage de l’indicateur est obtenu pour un volume de thiosulfate versé Véq = 10,8 mL.
En déduire la quantité n (en mol) d’acide thioglycolique contenu par gramme de solution commerciale pour permanente à froid.
Comment peut-on vérifier expérimentalement que l’iodate de potassium a bien été introduit en quantité suffisante lors de la première étape du protocole ?
Données:
Masse molaire (g/mol): H=1 ; C=12; N=14; O=16; S=32
Mon raisonnement:
Il y a plusieurs réactions redox:
Dans l'étape 1: IO3-+3I-+6H+=I3-+3H2O+I-
I3- peut se dissocier en I- et I2, d'où la coloration brune
Dans l'étape 2: I3-+2 HS-CH2-COOH=3I-+ HOOC-CH2-S-S-CH2-COOH + 2H+
Dans l'étape 3: I3-+2R-S-=3I-+R-S-S-R
Lors de l'étape 3, on titre le volume de I3- n'ayant pas réagit avec l'acide thioglycolique (car en excès).
Donc: CI3- en excès= (C2Veq)/V1= 0,054 mol/L
Le I3-, formé dans l'étape 1 est utilisé dans l'étape 2 et 3
Donc CI3-=CI3- ayant réagi avec acide thioglycolique + C I3- en excès
<=>CI3- ayant réagi avec acide thioglycolique= CI3- - C I3- en excès = C1 - C I3- en excès
Mais mon raisonnement doit être faux quelque part car le résultat est négatif ...
Voila !
Si quelqu'un peut m'orienter sur la/les bonne(s) voie(s),
Merci d'avance !
-----