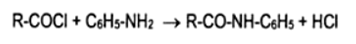Bonsoir,
Voilà j'ai un protocole expérimental et je ne comprend pas l'utilité du lavage, voici la réaction:
Le solvant c'est le dichlorométhane.
Une fois la synthèse terminée, on doit mettre le mélange dans une ampoule à décanter, laver avec de HCl puis avec NaOH ensuite avec de l'eau. après on doit faire une distillation pour enlever le dichlorométhane, puis une recristallisation avec un mélange éthanol-eau.
Et ma question c'est: pourquoi faire tout ça!on pourrait pas faire directement une distillation suivit d'une recristallisation? Après tout le HCl formé à la fin est soluble dans l'eau, on peut l'éliminer par une simple recristallisation dans l'eau.
Merci par avance
-----