Bonjour à tous,
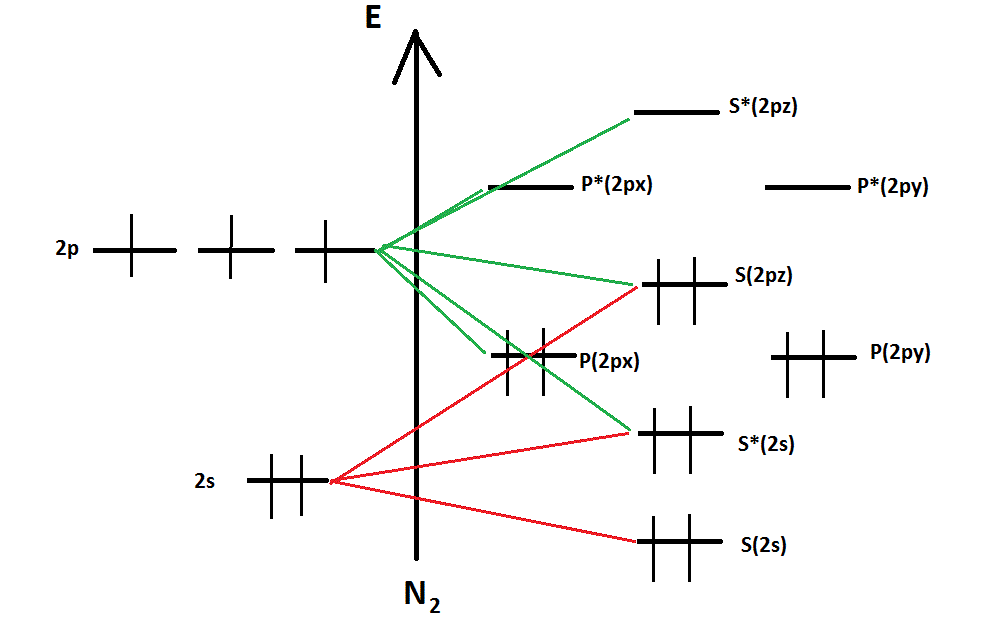
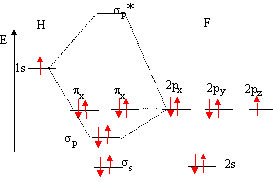
Je suis en ce moment en train de réviser ma chimie, et je n'arrive pas à comprendre une petite subtilité. Je sais qu'une O.A dégénérée est nommée ainsi lorsqu'elle est une des solutions de l'équation de Schrödinger, or si l'on regarde le diagramme ou le tableau que le professeur nous fournit, et que l'on s'en tient à cette explication, toutes les orbitales seraient dégénérées sauf 1s ?
D'avance merci de vos réponses.
-----