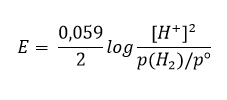Bonjour à tous! Je fais mon TPE sur la pile citron et j'explique son fonctionnement. On voudrait utiliser l'équation de Nernst mais on ne comprend pas tout...
Faut-il mieux utiliser cette formule 9717e0472d1b3295fc6e2bcb7f491629.png ou celle là 3321abbedab06e69d1c6eccdef13e0fb.png
Pourrait on me donner un exemple avec un métal et l'hydrogène comme oxydant?
Quelqu'un pourrait-il expliquer d'ou découle cette loi?
-----