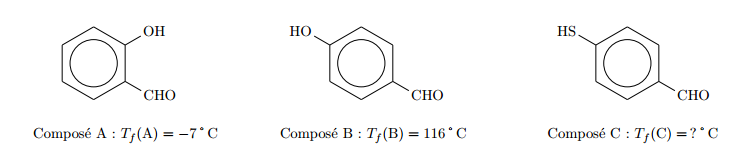
Bonjour à tous !
Prenons exemple sur le butane et le propan-1-ol et le glycol qui ont des masses molaires très voisines, mais leur points d'ébullition sont très différents, respectivement -0.5C, 85C et 198C.
Xc=2,5 Xo=3.5 Xn=3.
Je ne demande pas de faire l'exercice, car on l'a déjà fait, je demande quels sont les méthodes pour savoir ? Si je me rappel bien on utilise les forces de kesson et london ?
Si oui, merci de m'expliquer.
Cordialement.
-----