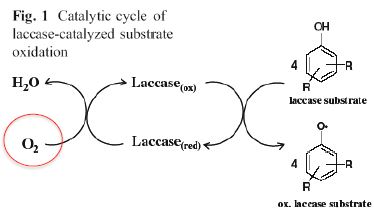
Bonjour,
La laccase est une enzyme qui contient du cuivre dans son site actif. Lorsque Cu3+ se fait réduire par l'oxygène en Cu2+ + électron, on passe de Laccase(oxydé) -> Laccase(réduite).
Or je ne comprends pas la demi-équation d'oxydation qui est couplée à cette réduction (à droite sur le schéma) ? Quel est le degré d'oxydation de l'oxygène du groupement hydroxyle de chaque phénol ? Comment on sait qu'il s'agit bien d'une oxydation ?
Merci!
-----