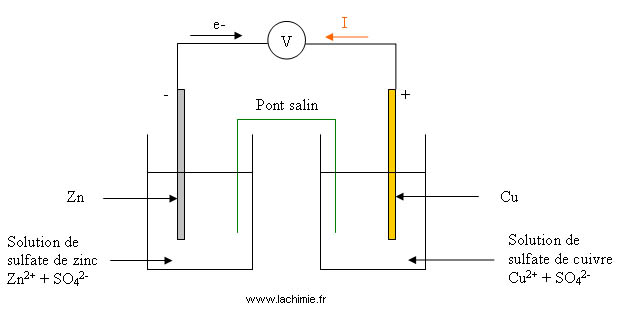
Bonjour, je pense avoir compris son fonctionnement qui est le suivant :
-Il y a une réaction d'oxydoréduction entre les deux couples oxyred Zn2+/Zn et Cu2+/Cu
-Zn et les ions Cu2+ sont les réactifs. Zn2+ et Cu sont les produits de la réaction
-Les électrons se déplacent uniquement dans les électrodes de la piles du + vers le - (sens inverse du courant électrique)
-Le pont salin qui relie les deux demies piles servent à garder une electro-neutralité en "injectant" des ions cl- dans la solution de sulfate de zinc et va capter des ions SO42- de la solution de sulfate de cuivre.
Jusque là tout va bien.
Si on décrit point par point le fonctionnement de la pile ça devrait donner quelque chose comme ça :
Zn perd 2e- qui vont être captés par le Cu2+ pour donner du Cu (forme réduit de l'ion Cu2+) et du Zn2+ (forme oxydée du zinc)
Le pont salin va "introduire" des ions dans les solutions de deux demi-piles pour compenser l'augmentation ou la diminution de la charge electrique des solutions de sulfate de zinc et sulfate de cuivre.
Ma question est la suivante : qu'est-ce qui provoque la perte de l'electron du Zinc puisque le Zinc et le Cu2+ ne sont pas en contact ?
Mon hypothèse est la suivante :
Je pense qu'un couple oxyred (par exemple Zn2+/Zn) lorsqu'ils sont en contact s'échangent constastement des electrons mais qu'il n'y a pas de réaction chimique visible car l'oxydant Zn2+ capte 2e- et se transforme en Zn et au même moment Zn va libérer deux 2e- et va se transformer en Zn2+
Pouvez vous m'éclairez sur ce point ?
-----