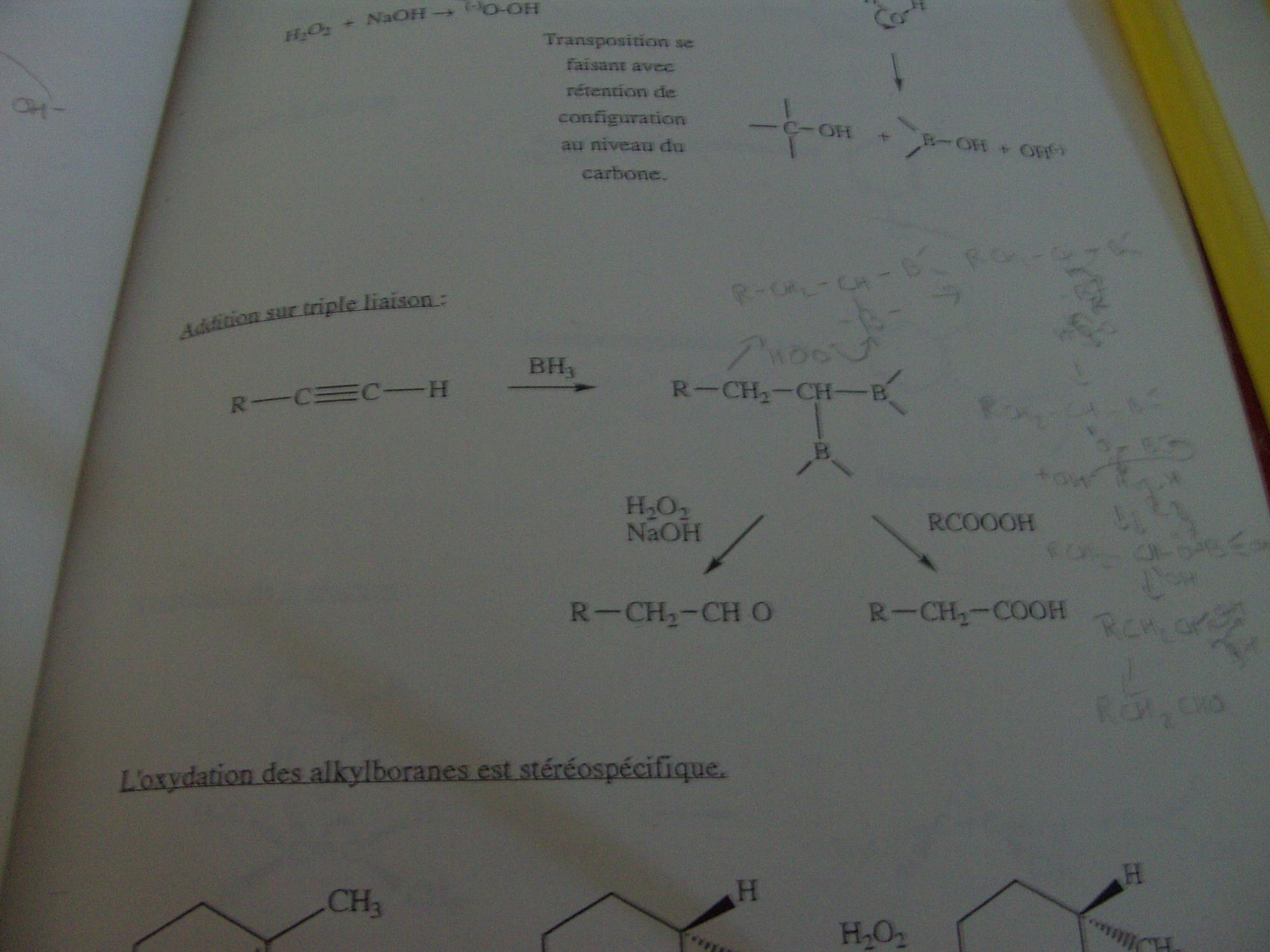
Bonjour,
En relisant un cours, j'essaie de faire les mécanismes de réaction et je tombe sur un couac. J'ai pris une photo de la réaction en question.
Alors pour la partie classique avec H2O2 et NaOH, pas de soucis ça passe tout seul, mais je vois pas comment faire avec le peracide. Je viens de chercher pendant plus d'une heure sur google et j'ai pas trouvé une seule trace de cette possibilité.
Bien entendu la dite réaction avait été passée sous silence pendant le cours. Une idée du mécanisme ou bien si en fait c'est une erreur?
-----