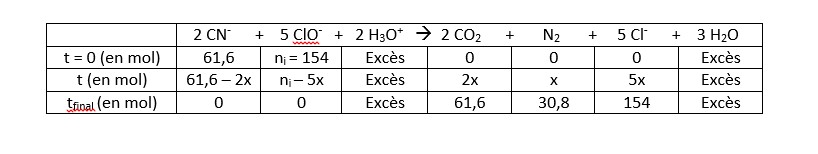Bonsoir,
Je viens de m'inscrire sur le forum, étant en première année de licence biologie/géologie, nous avons des cours de chimie au programme, parmi les autres matières scientifiques. Donc je pense que je posterai régulièrement lorsque j'aurai besoin d'aide.
Evidemment, je ne poste pas pour qu'on me donne un corrigé tout fait, mais plutôt pour qu'on m'explique là où je bloque.
Voilà donc l'énoncé de l'exercice :
Les ions cyanures CN- sont particulièrement toxiques.
[...] Du fait de leur toxicité, ils doivent être détruits avant rejet, par traitement avec des ions hypochlorite, suivant l'équation bilan :
2CN- + 5ClO- + 2H3O+ --> 2CO2 + N2 + 5Cl- + 3H2O
On souhaite neutraliser (= détruire) les ions cyanures CN- contenus dans 2 m3 d'une solution à 0,8 g.L-1 de cyanure de potassium, en utilisant une solution d'hypochlorite de sodium de concentration 2 mol.L-1.
Quel est le volume minimal de la solution d'hypochlorite de sodium nécessaire ?
En fait, première chose, je ne comprends pas bien la question. Concrètement, comment peut-on obtenir un volume minimal au vu de l'énoncé ? Quelqu'un peut expliciter rien que la question ? Ça m'aidera déjà pas mal.
Malgré tout, j'ai bien compris qu'il fallait faire un tableau d'avancement, que j'ai commencé de remplir.
Et voilà aussi ce que j'ai calculé pour commencer :
Quantités de matière n à t = 0.
Pour la solution de cyanure de potassium.
Concentration = 0,8 g.L-1 => CCN- = (0,8 g.L-1) / (MC + MN) = (0,8 g.L-1) / 26 g.mol-1 = 3,08.10-2 mol.L-1
Volume = 2 m3 = 2000 L
nCN- = CCN- x VCN- = 3,08.10-2 x 2000 = 61,6 mol
CCN- x VCN- = 0,8 g.L-1 x 2000 L = 1600 g => on a une masse de 1600 g d’ions cyanure dans les 2000 L de solution de concentration 0,8 g.L-1.
Pour la solution d’hypochlorite de sodium.
Concentration = 2 mol.L-1
Volume = ?
nClO- = CClO- x VClO-
Et donc après ça, je cherche le volume minimal de ClO-, mais je ne sais plus quoi faire.
Je vous remercie vraiment car j'aimerais bien comprendre cet exercice ce soir.
-----




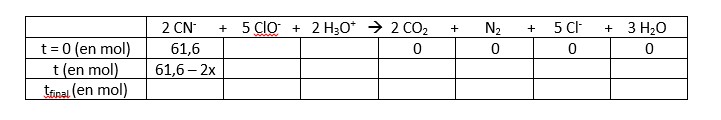
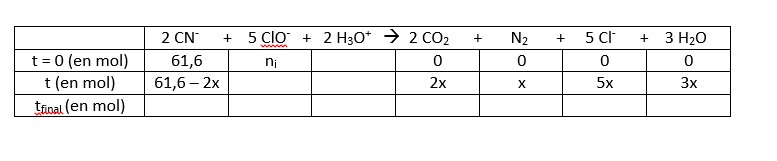
 Je posterai quand j'aurai fait mes calculs.
Je posterai quand j'aurai fait mes calculs.