Bonjour,
J'ai un exercice en PACES mais je n'aurai pas la correction, j'aurais voulu savoir si quelqu'un pouvait me dire où étaient mes erreurs, ne pas me les corriger mais me donner des indices pour essayer de les trouver par moi même... Merci
J'ai des doutes en ce qui concerne les degré d'oxydation lorsqu'il y a S, N ou Cl, pour vous éviter de tout regarder, je vous les mets en gras.
Donner le degré d'oxydation des éléments constitutifs des composés suivants :
CO : C = +II O=-II
CO2 : C=+IV O2=-II x 2 = -IV
COCl2 : C=+IV O=-II Cl2=-II
HCO3- : H=+I C=+IV O3 = -VI
HC2O4- : H=-I C2=+IV x 2 = +VIII O4=-VIII
NO : N=+II O=-II
NO2 : N=+IV O2=-IV
NO+ : N=+III O=-II
NH4+ : N=-III H4= +I x 4 = +IV
POCl3 : P=+V O=-II Cl3=-III
H2S : H2=+II S=-II
SO2 : S=+IV O2=-IV
H2SO4 : H2=+II S=+VI O4=-VIII
HClO ; H=+I Cl=+I O=-II
ClO-: Cl=+I O=-II
ClO2- : Cl=+III O2=-IV
HIO3 : H=+I I=+V O3=-VI
V2O5 : V2=+X O5=-X
VO2+ : V=+V O=-IV
Fe2O3 : Fe2=+VI O3=-VI
CrO42- : Cr=+VI O4=-VIII
CrO3 : Cr=+VI O3=-VI
CH4 : C=-IV H4=+IV
CH3Cl : C=-IV H3=+III Cl=+I
CH3OH : C=-II H3=+III O=-II H=+I
CH2==CH2 : C=-II H2=+II
Merci...
-----





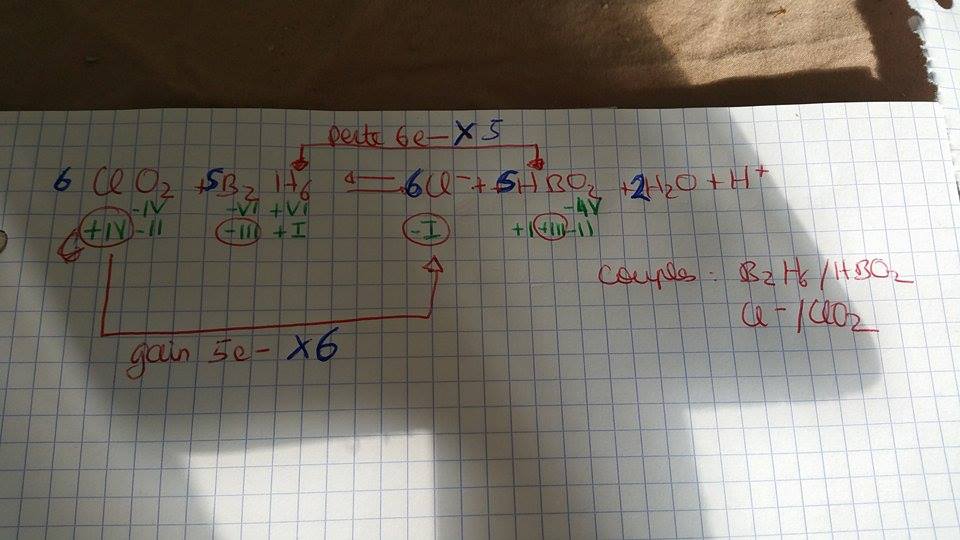
 ...
...
