Bonjour,
J'ai à ma disposition deux sources d'information normalement crédibles mais qui se contredisent concernant l'étape déterminant la vitesse de réaction lorsque plusieurs réactions se succèdent.
Selon une source, c'est l'étape ayant le complexe activé le plus élevé qui serait déterminante alors que l'autre source prétend que c'est l'étape ayant la plus grande énergie d'activation.
Personnellement, je pourrais croire que les 2 pourraient être vraies: si tout se passe dans un système isolé l'énergie dégagée par la première étape pourrait être utilisée par les réactifs de la deuxième étape, ce qui me porterait à conclure que c'est le complexe activé qui importe mais si la chaleur peut se perdre dans le système alors ce serait l'énergie d'activation qui serait importante.
Mais j'aurais tendance à croire que les graphiques doivent être compris comme décrivant ce qui se passe dans un système isolé, ce qui me pousse à préférer la première explication.
Suis-je dans le champ?
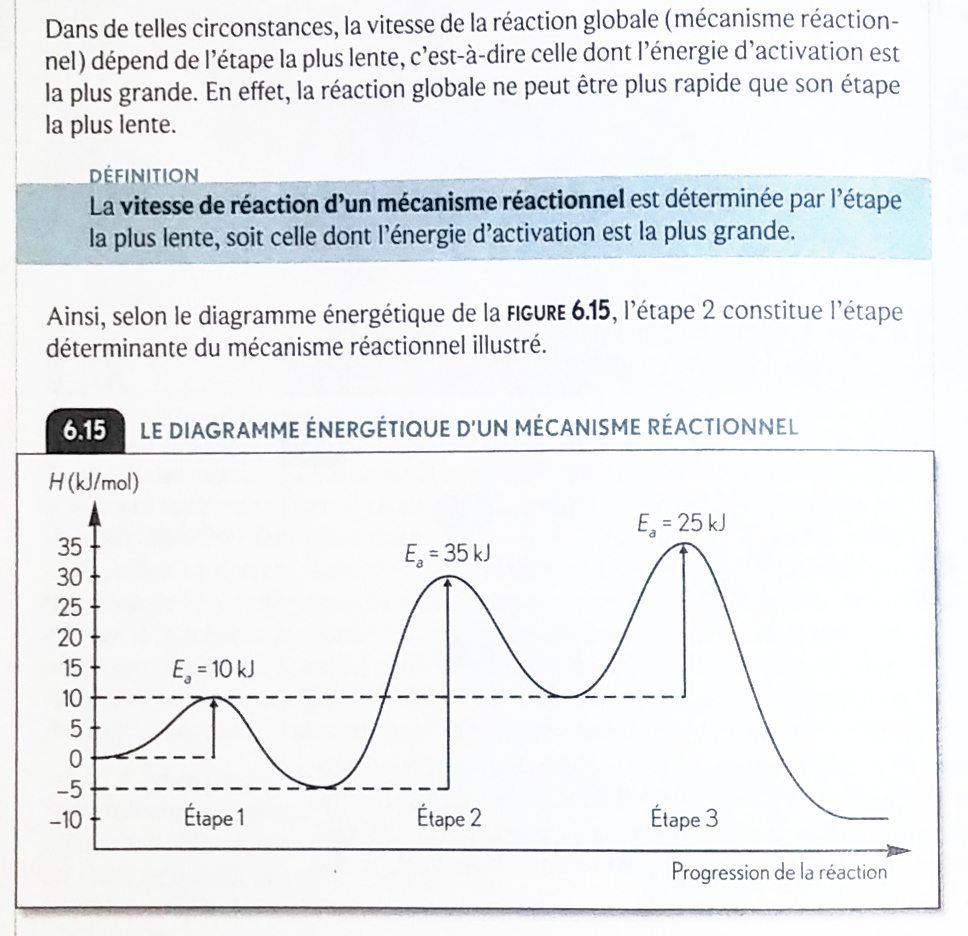
Je joins une image permettant de voir ce qu'indiquent mes 2 sources.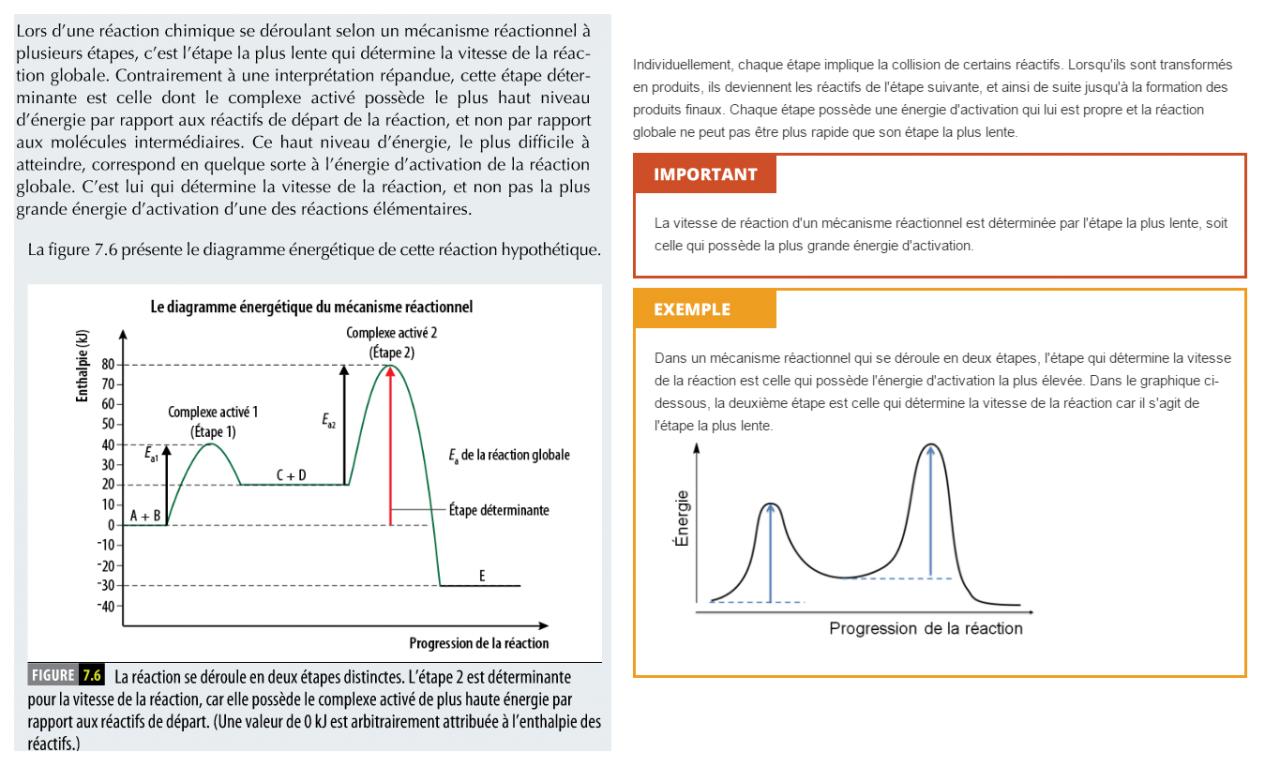
-----