Bonjour à tous,
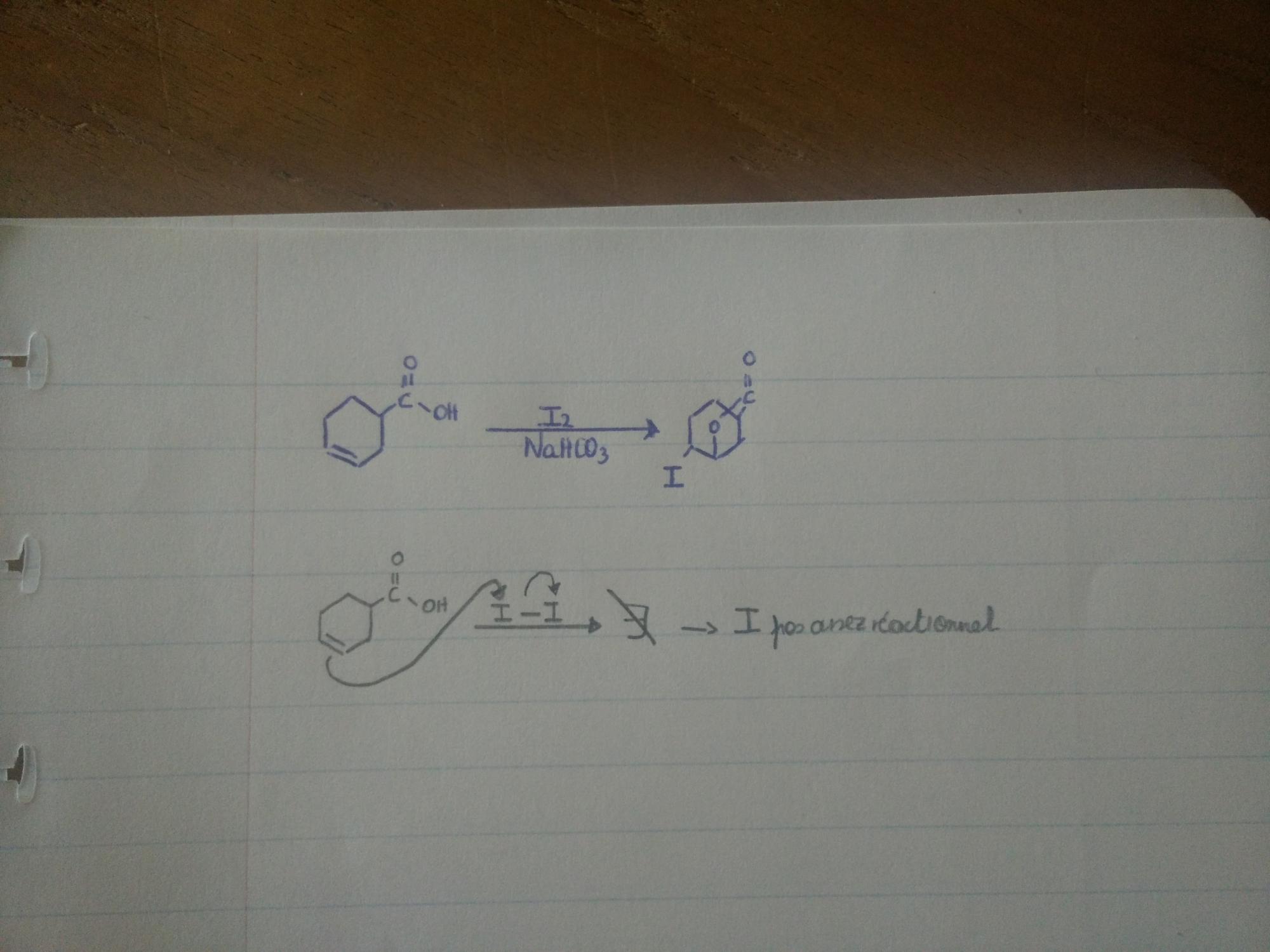
J'ai reçu un exercice où je dois retrouver le mécanisme de cette réaction organique. On observe la formation d'un ester et j'ai directement pensé à une halogénation double de l'oléfine suivi d'une synthèse de Williamson intramoléculaire d'ester entre un halogène et l'acide carboxylique déprotoné par NaHCO3 (hydrogénocarbonate de sodium).
J'ai repéré plusieurs problèmes.
- On additionne le dihalogène qui est ici I-I. Mais il n'est pas assez réactionnel que pour halogéner les 2 carbones de l'oléfines. J'ai en effet vu en cours que c'est uniquement possible avec Cl2 et Br2, la réaction avec F2 étant trop violente et celle avec I2 impossible car ce dernier n'est pas assez réactionnel.
- Imaginons que les 2 carbones de l'oléfine se font halogéner (ce que je pense impossible avec l'I2) et que l'acide carboxylique a été déprotoné, quelle est la sélectivité de la réaction intramoléculaire de Williamson ? Sur quel carbone se ferait l'attaque de l'oxygène ?
Je vous remercie d'avance.
-----