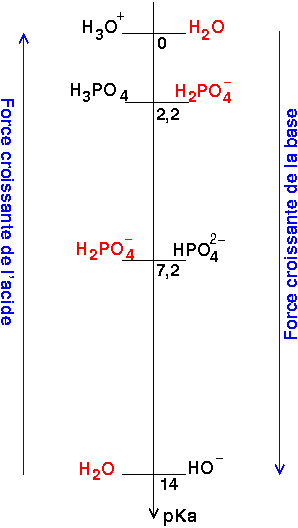
Salut a toute la communauté et surtout excuser moi pour le derangement depuis ce matin je but sur un exo voila le sujet : on donne pka(H3PO4/H2PO4 moin)=2,2 et Pka(H2PO4 moin/HPO4 2moin)=7,2 le ph d'une solution contenent 0,1M de NaH2PO4 est ? Voila ce que j'ai fait ph=1/2(pka-logC) meme la si le chemin est juste je bloque sur le pka a utiliser svp aider moi
-----