Bonsoir !
J'aimerais éclaircir quelques points pour lesquels je n'ai pas trouvé d'explications claires :
Pour moi, un amphotère est une espèce chimique pouvant se comporter à la fois comme un acide ou comme une base, est-ce que c'est bien le cas ? Un acide aminé serait donc un amphotère ?
Ou bien est-ce qu'on parle d'amphotère dans le cas de l'eau, qui peut se comporter comme une base dans le couple [H3O+/H2O], et comme un acide dans le couple [H2O/HO-]*?
Est-ce que les termes amphotère et ampholyte sont synonymes*?
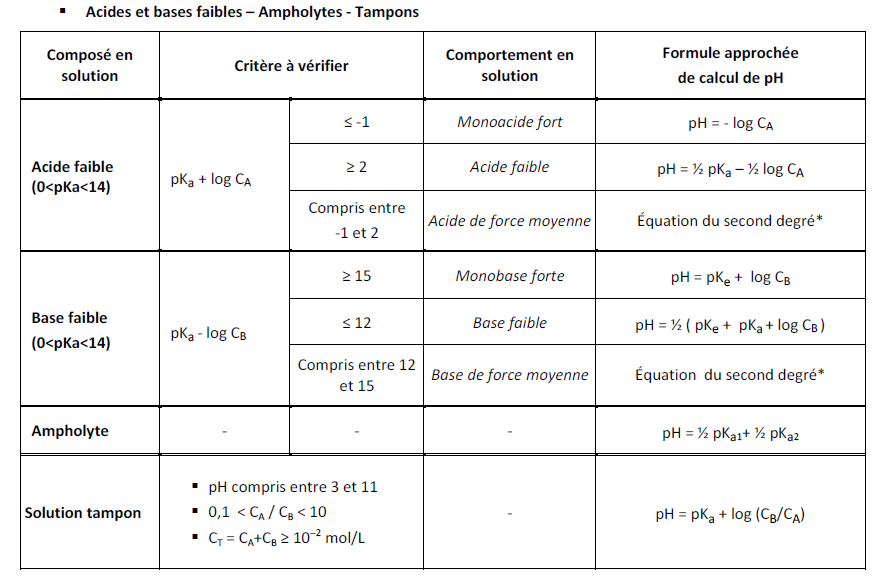
Dans le cas où un acide aminé est bien un amphotère, j'ai trouvé cette formule pour calculer le pH solution*: pH = (pKa1 + pKa2)/2.
Mais dans le cas d'un acide aminé à chaîne latérale ionisée, et qui aura donc 3 pKa, comment calcule t-on le pH*? En adaptant la formule*: pH = (pKa1 + pKa2 + pKa3)/3*?
Merci d'avance à ceux qui auront le courage de lire toutes mes questions et d'y répondre ^^.
Michie
-----