Bonjour,
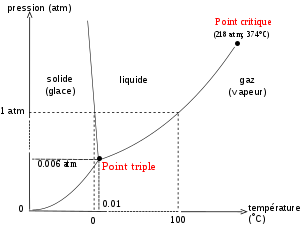
Je me pose une question sur la pression partielle d'un gaz. Prenons un verre rempli d'eau à 20°C dans une pièce de même température et non saturée en vapeur d'eau. L'eau du verre est capable de s'évaporer, car à la surface les molécules d'eau subissent une pression partielle suffisamment faible pour que l'on se trouve à droite des courbes du diagramme de phase.
Ce que je ne comprends pas, c'est: pourquoi ce qui est important pour que l'eau de surface puisse s'évaporer est uniquement la pression partielle et non pas la pression totale.
Si on imagine la pression comme une résultante d'atomes qui se frappent les uns les autres, alors ce qui vient frapper la surface de l'eau ce sont tous les atomes et non pas uniquement les molécules d'eau.
Est-ce que ma question est assez compréhensible?
Merci =)
-----