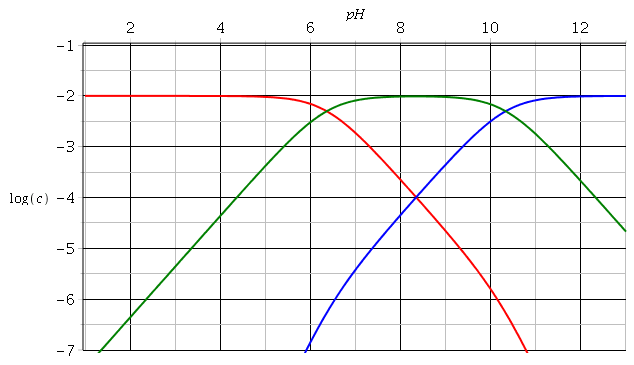
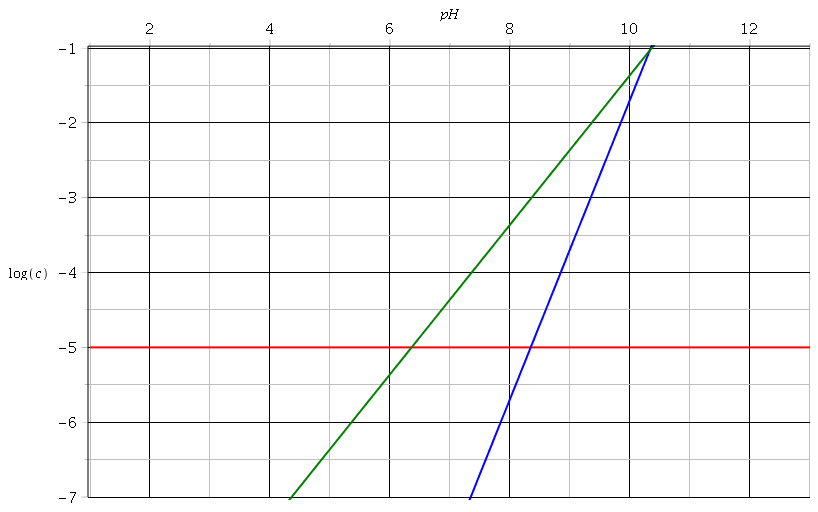
Bonjour à tous et toutes , j’ai du mal à comprendre le diagramme de sillén en mettant en lien celui pour déterminer le pH d’équilibre de CH3COOH À 10-2M et celui des espèces carbonatés:
H2CO3<->HCO3- + H+ , ka1=10^-6,36
HCO3<–> CO3^-2+ H+. , ka2= 10^10,33
Je vous joint les 2 diagrammes .
En fait c’est l’evolution Des concentrations que je ne comprends pas . Je sais que la [H2CO3] reste constante ( en ne sachant pas pourquoi) . Même en admettant cela je ne comprends pas l’evolution DES concentrations en CO3^2- et HCO3-. En m’aidant Du diagramme de CH3COOH je trouve que cette évolution des concentrations des espèces carbonates devrait se faire ainsi:
Je vous joint une photo ( c’est la plus petite des 3 et avec le moins de valeurs) D1DF549E-8251-4315-A0EB-0DD5453D5469.jpgCEF5A7D1-A66F-4986-976F-005429199ACA.jpgBDA4DDF9-8E68-411E-B0EC-27EA18DAFA68.jpg
-----