Dans des conditions exemptes de solvant et à 80 ° C, une conversion rapide et propre à médiation par DMAP ou imidazole d'acétates cycliques Morita-Baylis-Hillman (MBH) en les γ-céto allyl phosphonates correspondants avec des rendements de 70-93% . Cette substitution nucléophile allylique fonctionne bien avec les acétates primaires et secondaires portant en position β 'des groupes alkyle linéaires ou ramifiés et des groupes aryle.
DOI: 10.1021/acs.joc.5b02106
https://pubs.acs.org/doi/abs/10.1021/acs.joc.5b02106
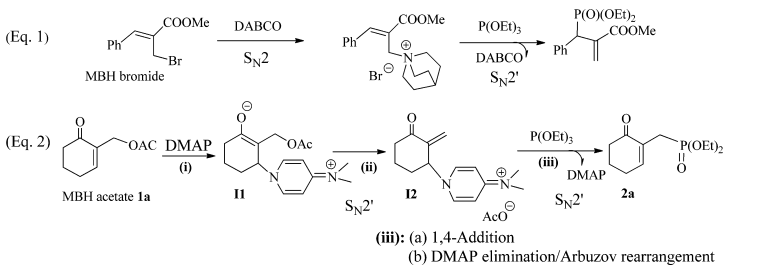
Dans une étude antérieure, Kim et ses collaborateurs ont indiqué que, lors de la réaction des bromures de MBH primaires avec le triéthylphosphite, le DABCO se comportait comme un nucléophile dur qui déplaçait directement l'ion bromure via une réaction SN2, puis le triéthylphosphite. nucléophile souple, mis à réagir sur le sel de DABCO résultant dans une libération de 1,4-addition / DABCO, donnant les phosphonates de SN2'. Dans la présente étude, le DMAP, connu pour être un nucléophile doux, a tout d'abord réagi dans une addition / élimination en 1,4 du fragment acétoxy, donnant le sel de DMAP SN2'sur lequel le phosphite de trihyle a réagi en outre dans un ß'-1. 4-addition / libération de DMAP, donnant le phosphonate de SN2'. Par conséquent, la régiosélectivité observée dans les deux protocoles est différente.
En effet, dans l'étude précédente, la substitution nucléophile allylique globale sur les dérivés de la MBH donnait les produits de type SN2 '; dans le présent travail, on obtient les produits de type SN2 issus de deux produits de type SN2' successifs.
-----


