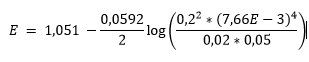Bonjour à tous,
J'ai une question concernant l'effet d'un ajout de 26 mL de NaOH 0,09 mol/L dans le compartiment du souffre de la pile suivante :
Hg 2+ (0,02mol/L) | Hg || SO42- (0,2 mol/L) | S2O62-
On nous demande de calculer le nouveau potentiel après cet ajout.
On est à pH 2
Les demi-réactions sont les suivante :
- Hg 2+ + 2e- <--> Hg (E°=0,851)
- 2SO4 2- + 4H+ + 2e- <--> S2O62- + 2H2O (E°=-0,2)
La réaction de la pile : Hg 2+ + S2O62- + 2H2O --> Hg + 2SO4 2- + 4H+ + 2e-
Est-ce que l'ajout du NaOH va juste modifier la concentration du souffre, ou l'effet basique du NaOH aura une influence sur le potentiel de la pile ?
Nombre de mole de NaOH = 2,34 E-3
En toute logique, la concentration de SO42- devrait changer et devenir égale à 0,2/(1+26 E-3) = 0,195 mol/L, de là je modifie simplement la concentration dans l'équation de Nernst ?
Merci d'avance pour votre aide
-----