Bonjour à tous !
Aujourd'hui en travaillant mon cours de chimie physique j'ai trouvé comme un paradoxe que je n'arrive pas à résoudre ;
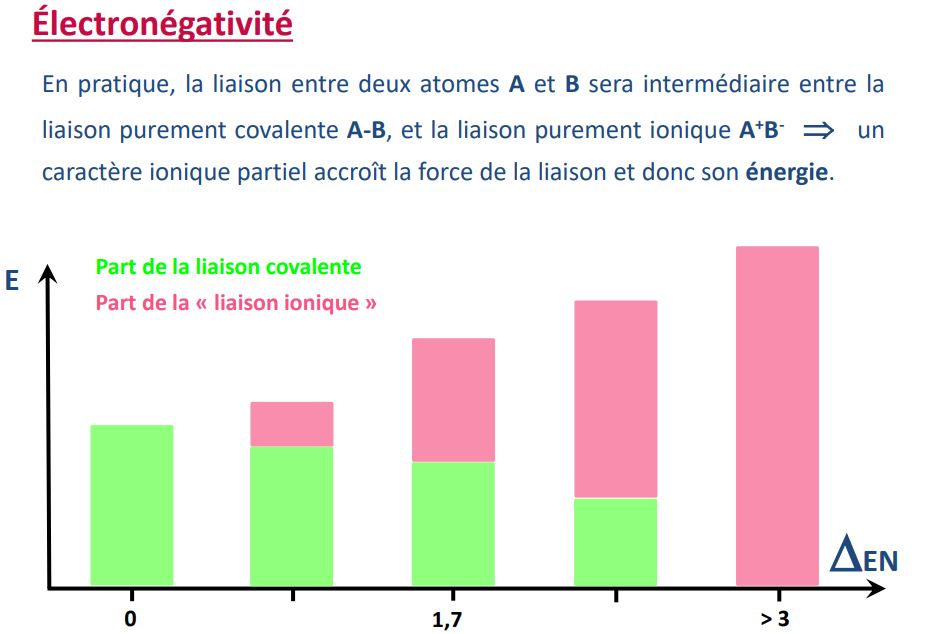
On m'a toujours dit (et je viens de retrouver ceci sur beaucoup de pages web) que la liaison covalente était plus forte que la liaison ionique. Seulement voici un slide du cours qui semble dire le contraire (à moins d'une mauvaise interprétation de ma part ??)
Voici le slide en question :
Selon ce que j'y comprend, la liaison ionique est plus forte et ainsi plus la différence d'électronégativité est élevée, plus la liaison est forte et donc c'est assez paradoxal.. Car je suis à peu près sûr que des électrons mis en commun sont plus fortement liés que des atomes qui le sont par une interaction purement physique. D'ailleurs on m'a enseigné que par exemple la notation NaCl était fondamentalement fausse car ce serait plutôt Na+Cl- car les deux ne sont pas fort liés..
Merci pour votre éclairage!
-----