Bonjour, on me demande de résoudre le dernier exercice de mon chapitre sur les pH et comme je m'en doutais il est extrêmement dur
Voici l'énoncé :
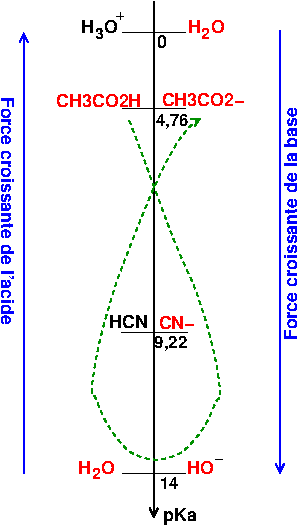
Il faut déterminer le pH d'une solution de 1L obtenue par dissolution de
- 0.3 mole de CH3COOH
- 0.2 mole de CH3COONa
- 0.2 mole de NaOH
- 0.05 mole de KCN
Je ne sais même pas par ou commencer, là on a plus de 2 espèces ajouter
Y a t'il une méthode particulière ?
Quelqu'un peut il me guider ?
Merci d'avance
-----