Bonsoir
J'ai un exercice à faire sur une réaction d'oxydoréduction dans une pile et je voudrais savoir si quelqu'un pouvait confirmer mes résultats ou m'indiquer si j'ai fait des erreurs...
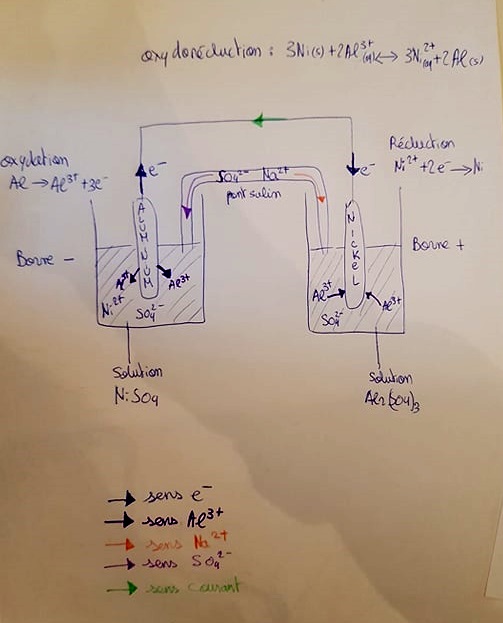
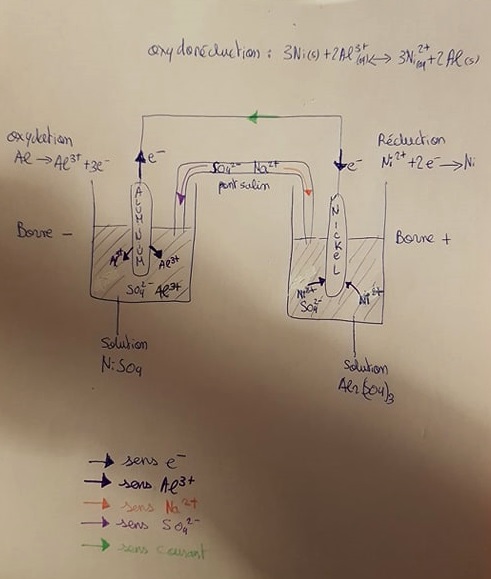
1. On réalise une pile avec les couples Ni2+(aq)/Ni(s) et Al3+(aq)/Al(s). La lame de nickel trempe
dans 150 mL d’une solution où 2 g de sulfate de nickel (NiSO4) ont été dissous et la lame
d’aluminium trempe dans 150 mL d’une solution où 2 g de sulfate d’aluminium (Al2(SO4)3) ont
été dissous. Le pont salin est constitué de sulfate de sodium.
a) Faire un dessin de cette pile.
Je vous joins le dessin final plus bas
b) Montrer que l’équation 3 Ni(s) + 2 Al3+ (aq) <-> 3 Ni2+ (aq) + 2 Al(s) peut rendre compte de
la transformation de la pile.
Là je ne sais pas vraiment ce qu'ils veulent mais j'ai dit :
du côté de l'anode s'opère une réaction d'oxydation selon : Al (s) -> Al3+ (aq) + 3e-
du côté de la cathode une réaction de réduction selon : Ni2+ (aq) +2e- -> Ni
On a donc la réaction d'oxydoréduction suivante : 2Al -> 2Al3+ + 6e-
3Ni2+ + 6e- -> 3Ni
l'équation bilan est donc 2Al + 3Ni2+ <-> 2Al3+ + 3Ni Ou encore 3Ni + 2Al3+ <-> 3Ni2+ + 2Al
c) la constante d'équilibre associée à cette équation est Kc = 10^-143
quel sera le sens d'évolution spontané de la réaction de la pile?
Au vu de l'équation et du fait que Kc < 1 on a une reaction tendant vers le sens inverse et donc vers la réaction 2Al3+ + 3Ni
d) déterminez le sens du courant électrique et le sens de deplacement des porteurs de charges dans la pile et hors de la pile , placez des flèches et légendez le schéma.
Ça du coup c'est à voir sur le schéma
Voilà merci beaucoup d'avance
chumie bureau.jpg
-----