Bonjour à tous,
Je suis en alternance et mon IUT souhaite que je rédige régulièrement un rapport sur l'un des appareils de laboratoire que j'utilise. Pour cette fois ci, je décide d'écrire sur le Karl Fischer. Le problème c'est que je comprends pas le principe assez précisément, et j'ai beau chercher des informations, plusieurs questions restent.
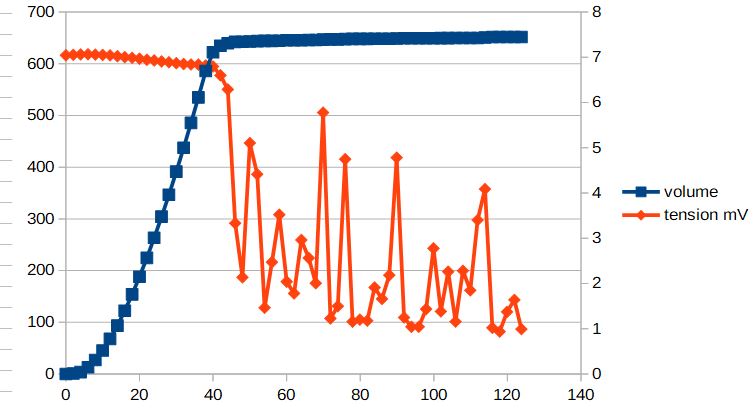
Donc dans mon entreprise, j'utilise un Karl Fischer, titrage volumétrique, avec un courant imposé à 50 microA. Nous utilisons l'imidazole comme base
Déjà, quand je fais des recherches sur internet, je vois un coup que l'imidazole est une base forte, et un autre coup que c'est une solution tampon avec un pKa = 6.5 Je pencherais plutôt pour la solution tampon mais je ne veux pas écrire de bêtise...
Concernant la stoéchiométrie de la réaction : c'est le fait qu'on utilise comme solvant le méthanol qui fait que la stoéchiométrie est de 1mole d'h2o pour un mole de I2? (mais j'ai lu partout qu'on a découvert que récemment que le méthanol intervenait dans la réaction. Comment faisait-ils avant, ils se trompait systématiquement vu que pas le bon coef stoechio? Il prenait na = nb sans comprendre pourquoi ?)
Ensuite, sur le principe en lui même : j'ai un courant imposé à environ 50microA. La tension avant ajout d'échantillon est <200mV et lorsque j'ajoute mon échantillon, ça monte à environ 600mV. Puis on ajoute le titrant et le potentiel diminue très fortement au point d'équivalence. Mais je ne comprends pas : qu'est ce qui fait augmenter la tension (l'eau? le réactif? si ce sont les réactifs, lesquels?) ? Qu'est-ce qui la fait baisser? J'ai lu que la tension diminuait lorsqu'un excès d'iode apparait car le diiode I2 se réduit à un potentiel voisin de celui où s'oxyde les ions iodure, mais même là, j'ai du mal à comprendre... Pourquoi le fait qu'il y ait réduction et oxydation en même temps fait que le potentiel diminue? J'ai lu dans un autre poly que le fait qu'il y ait oxydation et réduction en même temps augmentait la résistance. Mais quand on prends la formule U=RI, si R augmente, alors U augmente... (je dis peut-être des aberration là, mais j'ai jamais réussi à comprendre tout ce qui touche à l'électricité ^^" )
Est-ce que la loi de Nernst intervient?
Bref, je suis un peu perdu sur le principe, je ne comprends pas pourquoi le potentiel augmente quand on ajoute l'échantillon à doser, ni pourquoi il diminue lorsqu'on atteint le point d'équivalent. Je me demande si l'intensité est constante à 50microA, où si c'est le courant qui est envoyé par l'appareil qui est constant, mais que l'intensité varie en fonction de la réaction en cours, etc etc
PS : je n'ai pas encore eu de cours d'électro chimie, et j'ai beau chercher, je ne comprends pas le principe et ne sait pas lire les courbes intensité-potentiel
Si vous pouviez me renseigner sur le sujet, merci d'avance
-----