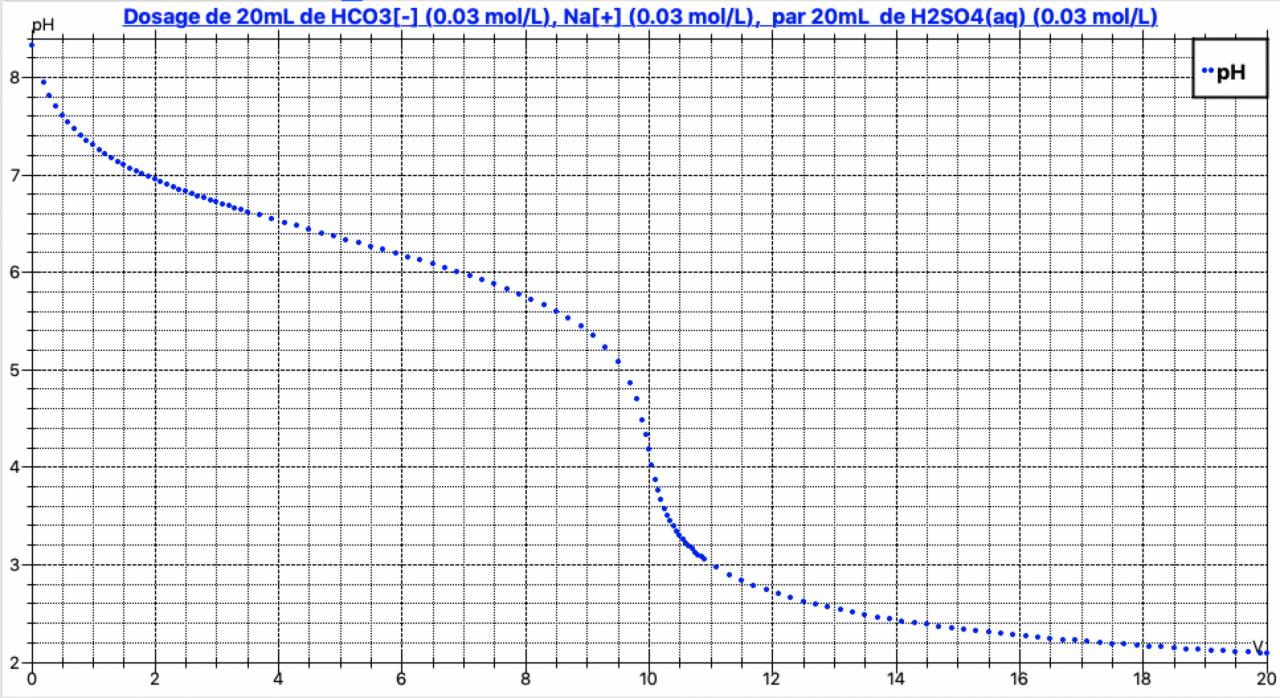
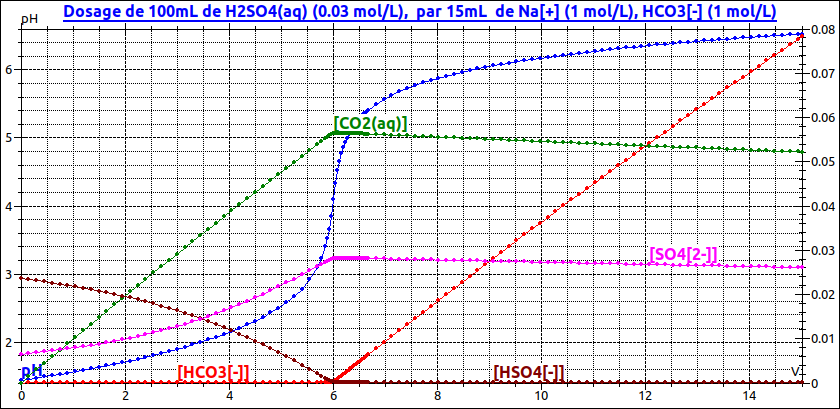
Bonjour, j'ai un Tp où je dois étalonner solution d'acide sulfurique H2SO4 à partir d'une masse m1 d'hydrogénocarbonate de sodium NaHCO3 connue. Mais je n'arrive pas à trouver l'équation de réaction.
J'ai écris la dissociation des sels dans l'eau:
NaHCO3 = Na++HCO3- ou NaHCO3 = Na++CO32-+H3O+
H2SO4=2H3O++SO42-
Merci de votre aide.
-----