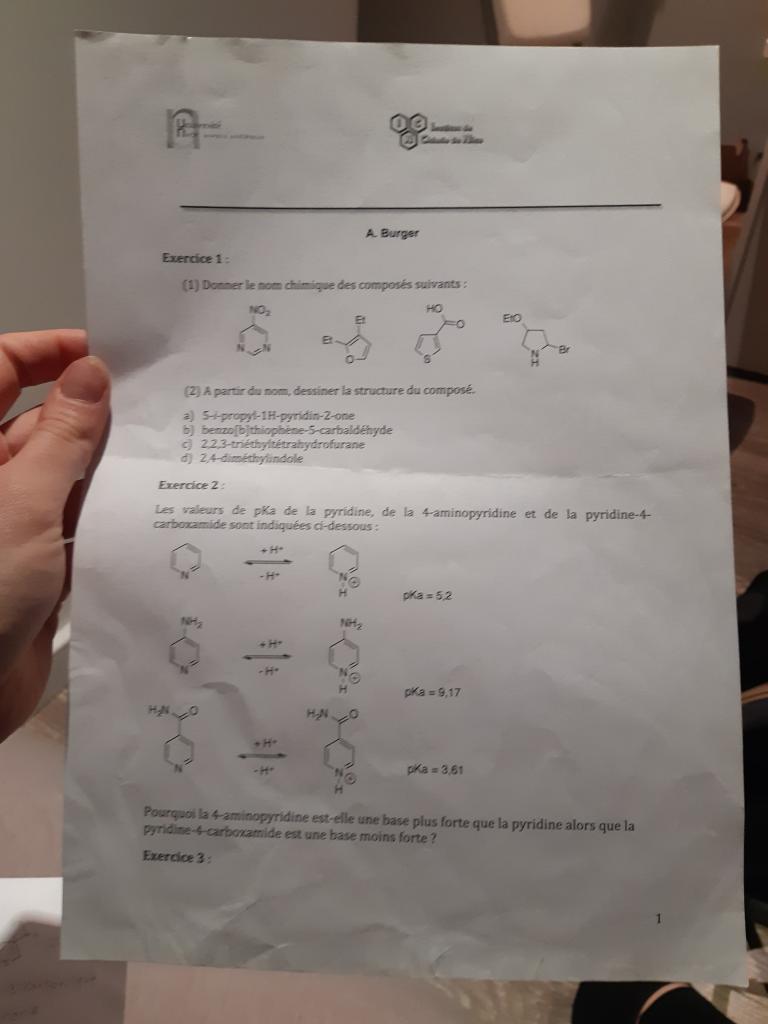
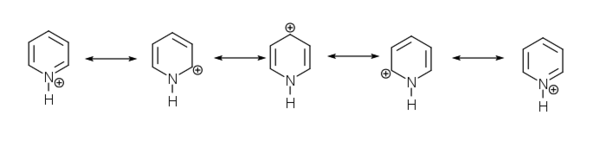
Bonjour tout le monde!
alors voila je suis bloqué sur un problème depuis quelque-jour sur le sujet ci dessous:
Je ne comprends pas pourquoi la pyridine est moins acide que le 4 aminopyridine?
et concernant le 4-carboxamide aussi?
Cordialement,
napoleondynamique
-----