Bonjour,
Je suis très mauvais en chimie et j'ai cet énoncé et les question qui suivent devant moi :
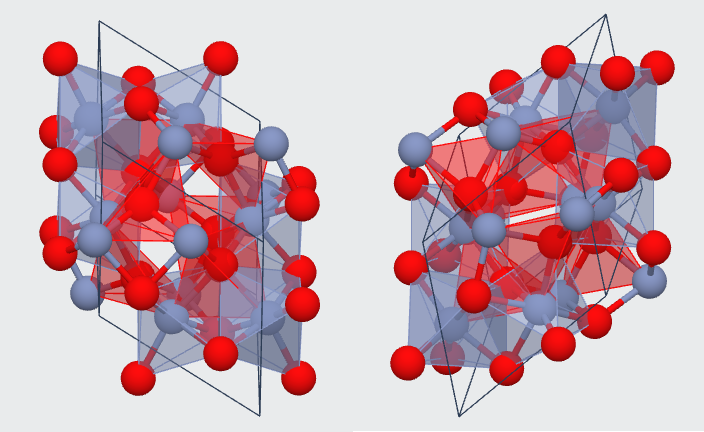
"Le vert viridien Cr2O3 est un pigment synthétique, mis au point par Vauquelin dans les années 1800. La couleur du vert viridien est caractéristique de l’ion Cr3+ en environnement octaédrique : deux transitions d-d apparaissent lors de l’éclatement du champ, respectivement dans les régions 580-650 nm et 420-460 nm"
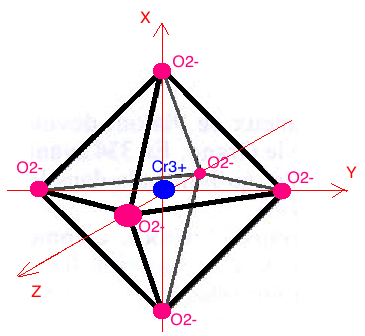
Justifiez « la séparation des niveaux d’énergie des orbitales d » lors de la formation d’un complexe octaédrique centré sur l’ion Cr3+.
Représentez la configuration électronique des orbitales d de l’ion Cr3+ dans la structure Cr2O3.
Je ne comprends pas bien comment on puisse avoir un complexe octaédrique puisque le cation Cr3+ n'est pas entouré de 6 ligands, qui par ailleurs devraient être des O2- ?
Pour la seconde question je suis également embêté, je ne suis pas sur de bien comprendre ce qui rentre en jeux...
Merci de votre temps et investissements
-----