Bonsoir à tous,
J'ai eu des difficultés à traiter la 2ème question, s'il vous plait pouvez-vous m'éclaircir ?
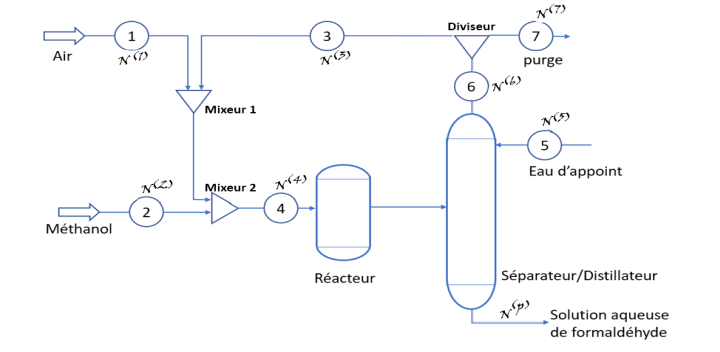
Dans ce procédé du méthanol est oxydé en utilisant de l’air comme source d’oxygène dans un réacteur à lit fixe contenant un catalyseur d’oxyde de fer-molybdène. Un flot de réactifs N(4) contenant 8% mol de méthanol et 10% mol d’oxygène est introduit dans le réacteur. Le taux de conversion du méthanol est complet. Le produit de réaction est envoyé dans un séparateur où le gaz inerte (l’azote) est purgé à travers le flot N(7) et une solution aqueuse de formaldéhyde (37wt%) est récupérée en bas du séparateur en raison de 3000 kg/min. La concentration de la solution aqueuse est obtenu en ajoutant de l’eau d’appoint à travers le flot N(5)
L’objectif de l’ingénieur(e) ici est :
1)Ecrire la formule stoechiométrique de la réaction
2)Calculer les débits de flux annotés sur le schéma
-----


