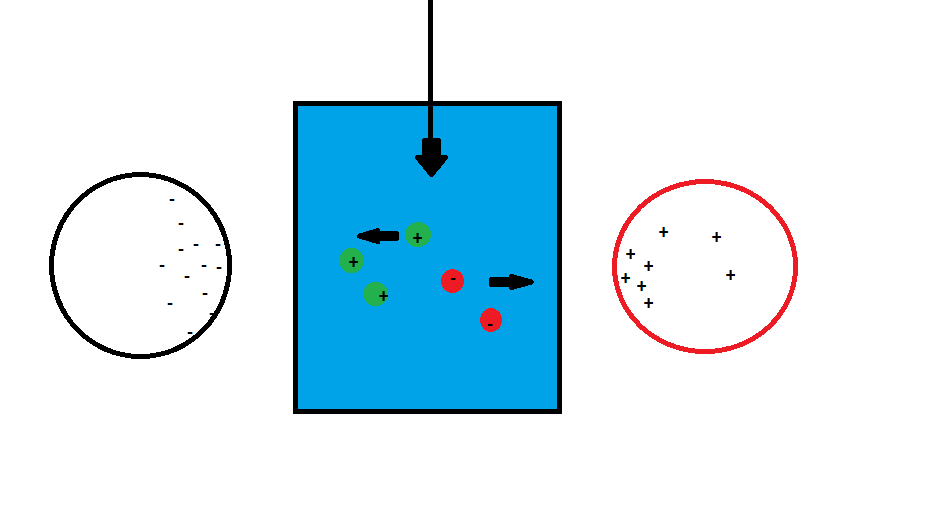
Salut,
Est-t-il possible d'isoler les cations des anions d'une solution (NaCl par exemple) et d'en faire deux solutions, une concentrée en cations (Na+), l'autre en anions (Cl-)?
Si c'est le cas, est-t-il possible d'en faire une batterie ?
Merci d'avance.
-----