Bonjour,
j'ai un peu de mal à visualiser le fonctionnement d'une pile de concentration, je vais alors expliquer le schéma, exposer ce que je pense être son fonctionnement et donner des éléments qui me semblent illogique :
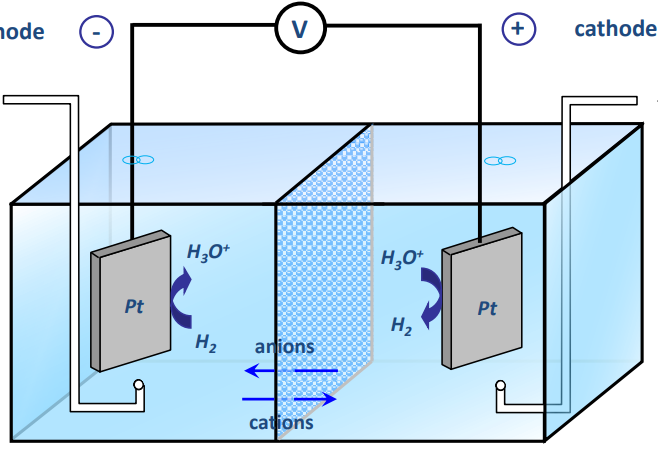
Dans chaque demi-pile, il y a barbotage d'hydrogène (qui vient de l'extérieur à une pression 1 atm). A gauche, dans l'eau, on verse une solution diluée (molarité de) de
ce qui nous amène a une solution de même concentration en
. On nous renseigne également sur le fait que l'ion hydronium créé dans la demi-pile de droite a une activité unitaire (on ne sait pas quelle concentration, mais cela est nécessairement relativement bien plus élevé que pour la demi-pile de gauche). On place de chaque côté un conducteur en platine reliés entre eux afin d'en faire des électrodes. On place au milieu un pont salin comme conducteur ionique (par exemple, un pont de KCl).
L'équation redox est donnée par :
Mon interprétation est la suivante :
La plus faible concentration en ion hydronium à gauche fait que le système va tendre à égaliser les concentrations à cause de la différence de potentiel créée. Ainsi, on aura à gauche une réaction d'oxydation et à droite une réduction.
Pour que la réaction d'oxydation ait lieu, l'hydrogène moléculaire se libère de 2 électrons qu'il cède à la lame de platine et forme ainsi avec l'eau 2 ions hydronium. De l'autre côté il y a réduction et c'est justement la lame de platine qui fournit des électrons aux ions hydronium pour former de l'eau et de l'hydrogène moléculaire. Ainsi, si une des lames est en excès d'électrons (à gauche) et l'autre en déficit (à droite), un courant électrique est généré par différence de potentiel et va de la lame de gauche (anode) vers la lame de droite (cathode).
Maintenant, passons aux éléments perturbateurs :
On dit tel quel que s'il y a courant dans le circuit métallique non fermé, il y aura forcément une accumulation de charges dans la cathode, et que donc le pont salin sert à envoyer des cations vers la cathode pour capter les électrons et vice-versa pour ainsi garantir une neutralité des électrodes et avoir une différence de potentiel qui n'est due qu'à la différence de concentration.
Donc : avec mon raisonnement, chaque électron donné à l'électrode de gauche est renvoyé à l'électrode de droite qui vient à le céder, c'est donc comme si l'électron était simplement dirigé de la partie gauche vers la partie droite, rien ne reste dans les électrodes. Ainsi, je ne vois pas quel rôle joue le pont salin. De plus, mon courant est dû à un excès d'électrons à gauche et à un déficit à droite, alors même que ces plaques doivent être électriquement neutres pour que la tension soit due à la différence de concentration.
Merci beaucoup à ceux qui accepterons de m'aider à comprendre où est la faille dans mon raisonnement.
-----