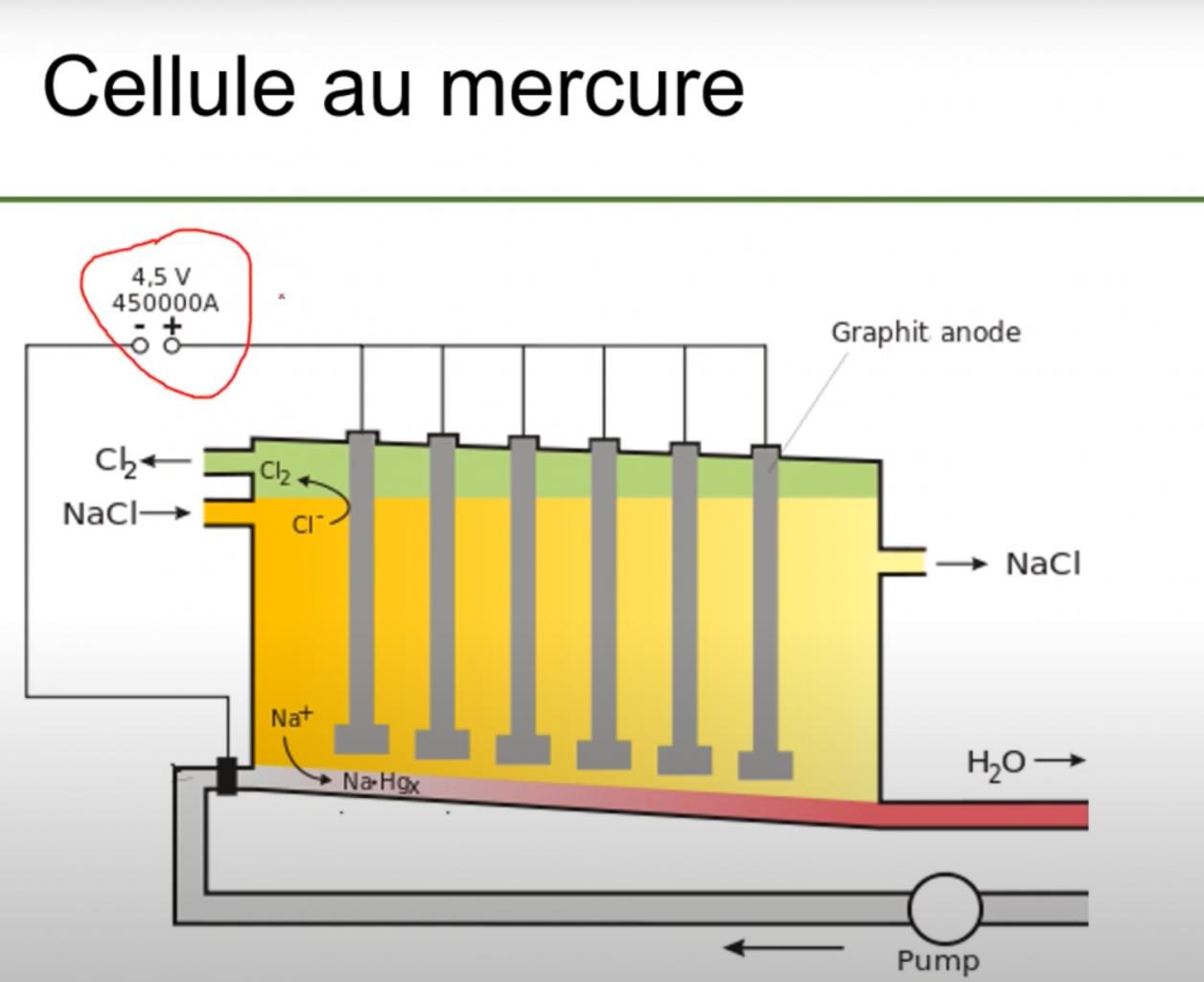
Bonjour,
J'avais vu une technique décrite dans un papier expliquant comment fournir du Na/Hg de façon continu au milieu réactionnel afin de réduire la molécule organique s'y trouvant. C'était une technique qui disaient de mettre une cathode au mercure et une anode au platine ou nickel dans un bain d'eau à 40% de NaOH dans un récipient différent du milieu réactionnel contenant la molécule à réduire.
Du coup mes connaissances en électrochimie sont assez limitées, et je me demandais à quoi devrait ressembler la cathode en mercure ? et pour l'anode une plaque de platine fera l'affaire ? Et lorsque la réduction de la molécule organique se fait que devient Na(Hg) ?
En vous remerciant.
-----