Bonjour, j'ai trouvé l'exercice suivant dans un livre:
On mélange 10.0ml d’une solution d’acide acétique CH3COOH (noté AcOH) et 6.0ml d’une solution de nitrite de sodium NaNO2, toutes les deux à la concentration de c0 = 0.10mol l−1. Déterminer la composition du système à l’équilibre chimique.
Données : pKA(AcOH, AcO−) = 4.8, pKA(HNO2,NO2−) = 3.2
J'ai appliqué la méthode de la réaction prépondérante. J'obtiens alors la réaction suivante: NO2- + AcOH = HNO2 + AcO-
J'ai réalisé la tableau d'avancement en concentration (voir bas de page)
Je calcule l'avancement grâce à l'expression de K°: K°=103,2-4,8=x²/(c0-x)²
J'ai alors l'équation suivante: x²(1-K°)+2c0K°x-c0²K°=0
Donc x=4,8 * 10^(-2)mol/L, puis j'en déduis les concentrations des produits et réactifs à l'état final.
Cependant, dans la correction, c'est un tableau en quantité de matière qui est utilisé et l'avancement trouvé est alors x = 6.6×10−3 mol l−1.
Le K° dans la correction vaut: K° = 10−1.6 = x²/ [ (6.25×10−2 − x)(3.75×10−2 − x) ].
Que ce soit avec un tableau en concentration ou en quantité de matière, je suis censé trouver la même chose, alors je ne comprends pas bien où est-ce que mon raisonnement cloche.
Merci de bien vouloir m'aider.
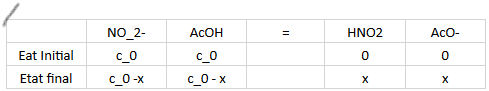
-----


