Bonjour!! Bon voilà, je voulais me mettre dans la catégorie "exercices de chimie" comme pour la bio, mais je n'en ai pas trouvée.
Oui, je fais des exercices (non demandé en classe, fait par moi-même encore) et je les ai fait, juste si on peut me corriger (si vous avez du temps). Il y a des choses que je n'ai pas compris, donc si j'ai faux, dite moi ce qu'il faut faire et comment le savoir!
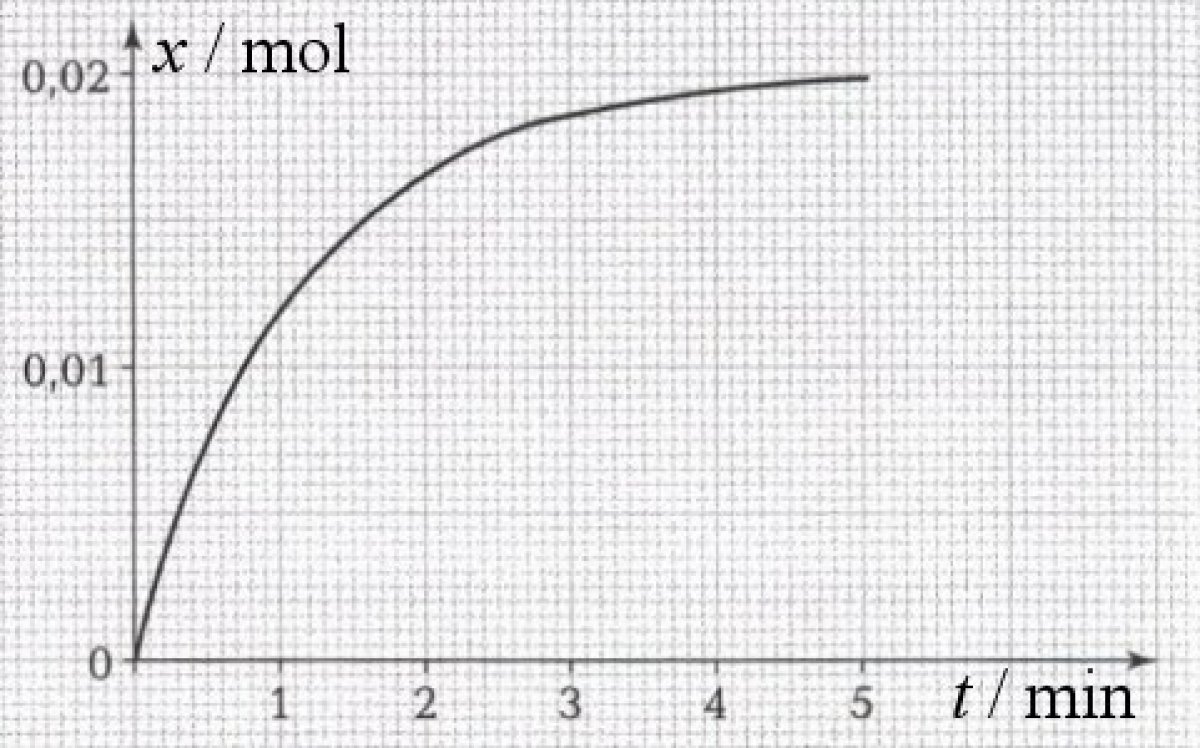
1. Définition et mesure du temps de demi-réaction.
Le temps de demi-réaction est le temps nécessaire pour que l'avancement de réaction atteigne la moitié de sa valeur maximale. Il est noté t1/2
Une réaction est terminée lorsque le temps écoulé depuis le début de la réaction est égal à deux fois le temps de demi-réaction.
Une réaction est terminée lorsque le temps écoulé depuis le début de la réaction est égal à 0,5 min.
D'après la courbe ci-dessous représentant l'évolution de l'avancement d'une réaction en fonction du temps, le temps de demi-réaction vaut 0,8 min.
REPONSE A ET B.
2. Des résultats de cinétique sont linéarisables en traçant 1/A (A est une concentration de réactif) en fonction du temps. La cinétique est donc d'ordre: Réponse ordre 2*.
3. Définition et mesure du pH des solutions aqueuses
Le pH d'une solution aqueuse est défini par la relation pH = -log[H3O+] où [H3O+] est la valeur de la concentration en ion oxonium exprimée en mol.L-1.
Le pH d'une solution aqueuse est défini par la relation pH = -ln[H3O+] où [H3O+] est la valeur de la concentration en ion oxonium exprimée en mol.L-1.
Le pH d'une solution aqueuse peut être mesuré à l'aide d'un papier-pH ou d'un pHmètre.
Le pH d'une solution aqueuse contenant des ions oxonium à la concentration de 10-2*mol.L-1*est égal à 2.
La concentration en ion oxonium d'une solution aqueuse s'exprime en fonction de son pH par la relation [H3O+] = 10pH.
REPONSE 1, 3 et 5 (la 4, c'est PH = 2).
4. La vitesse, v, de cette réaction chimique*: 2A + B →C
s'écrit*:
v = k (A) (B)
v = k (A)2*(B)
v = k (A) (B) / (C)
v = k (A) (B) / ©
REPONSE 2
5. Des résultats de cinétique sont linéarisables en traçant LnA (A est une concentration de réactif) en fonction du temps. La cinétique est donc d'ordre:
ORDRE 1.
6. Des résultats de cinétique sont linéarisables en traçant 1/A (A est une concentration de réactif) en fonction du temps. Le graphe obtenu est :
une hyperbole
une parabole
une droite
un palindrome
J'aurais dis la seconde et la troisième....
7.Diagramme de prédominance et relation entre le pH et le pKA*d'un couple acide/base.
Le couple acide/base A/B a un pKA*valant 4,0 à 25 °C.
Dans une solution de pH égal à 6,0 l'espèce B prédomine.
Dans une solution de pH égal à 3,0 l'espèce B prédomine
La relation entre le pH et le pKA*du couple est pH = pKA*+ log (A)/(B).
La relation entre le pH et le pKA*du couple est pH = pKA*+ log (B)/(A).
REPONSE pKa = *- log Ka et Ka = [A-][H+]/[AH], je dirais la dernière et la première*.
8. Etat final de la réaction d'un acide avec l'eau.
On considère la réaction de l'acide éthanoïque CH3CO2H avec l'eau se produisant dans une solution diluée d'acide éthanoïque.
CH3CO2H(aq) + H2O(l) = CH3CO2-(aq) + H3O+(aq)
L'état final de la réaction est un état d'équilibre chimique.
L'ajout de deux gouttes d'acide éthanoïque pur provoque la diminution du pH de la solution.
L'ajout d'une pointe de spatule d'éthanoate de sodium CH3CO2Na provoque la diminution du pH de la solution.
Lors de l'ajout de deux gouttes d'acide éthanoïque pur, l'état d'équilibre est déplacé dans le sens direct.
Lors de l'ajout d'une pointe de spatule d'éthanoate de sodium CH3CO2Na, l'état d'équilibre est déplacé dans le sens direct
REPONSE première et troisième (oui, vu que la réaction est fini à l'état final)
9. La vitesse d'une réaction d'ordre 1 est*:
proportionnelle à la concentration en réactif
proportionnelle au carré de la concentration en réactif
indépendante de la concentration en réactif
indépendante de la constante cinétique expérimentale
DERNIERE REPONSE
10. Caractéristiques d'un état d'équilibre chimique.
Lorsque la transformation chimique transformant les espèces A et B en espèces C et D a atteint un état d'équilibre,
la vitesse de la réaction directe est égale à celle de la réaction inverse.
au niveau microscopique il n'y a plus d'activité chimique.
l'équilibre est qualifié de statique.
à chaque instant il disparaît autant d'espèces A et B par la réaction directe qu'il s'en reforme par la réaction inverse.
REPONSE 2, 3 ET 4
11. Une constante de vitesse de 5.10-4*M-1*min-1*correspond forcément à*:
Comment savoir de quel ordre il s'agit*? Pseudo d'ordre 1*?
12. Acidité et basicité d'une solution. Calcul du pH.
Une solution acide est caractérisée par un pH inférieur à 7,0.
Une solution basique est caractérisée par un pH inférieur à 7,0.
On peut calculer le pH d'une solution par la relation pH = log [H3O+].
On peut calculer le pH d'une solution par la relation pH = -log [H3O+].
Si le pH d'une solution diminue, la concentration en ion HO-*augmente.
REPONSE 1, 4 et 5.
13. Propriétés de la constante d'équilibre de réaction K
La valeur de K*est indépendante de la composition initiale du système chimique.
La valeur du quotient de réaction dans l'état d'équilibre est celle de K.
La valeur de K ne dépend pas de la température.
La valeur de K se calcule à partir des concentrations molaires initiales des espèces dissoutes.
REPONSE 2 ET 4
14. La vitesse d'une réaction d'ordre 2 est*:
proportionnelle à la concentration en réactif
proportionnelle au carré de la concentration en réactif
indépendante de la concentration en réactif
indépendante de la constante cinétique expérimentale
REPONSE 2
15. La vitesse, v, d'une réaction chimique est
toujours positive ou nulle
indépendante de la température
dépendante de la concentration en réactifs
peut être négative
REPONSE 1 et 3
16. La valeur de la vitesse instantanée d'une réaction dépend :
de la température du système.
du volume du mélange réactionnel.
de la concentration en réactifs.
de la couleur des espèces chimiques.
REPONSE 1 et 3.
Je suis bien tentée de dire aussi le volume car je me dis aussi que si par exemple (stupide) on a 5 enzymes avec 5 substrats correspondant, ben, ils ont moins de chance de se rencontrer si il était dans un volume de 5 litre que de 1 litre (par exemple*! Ha*! Ha!)
17. L'unité de la longueur d'onde est*:
le mètre par seconde et ses sous multiples.
le mètre et ses sous multiples.
l'année lumière.
La seconde et ses sous multiples.
REPONSE 2
18. Au cours d'une réaction acido-basique*:
des électrons sont échangés.
des protons sont échangés entre un acide et une base appartenant à deux couples différents.
des protons sont échangés entre un acide et une base appartenant au même couple.
une base et un acide sont consommés.
une base et un acide sont formés.
REPONSE 3,4 ET 5
19. Une constante de vitesse de 500 min-1*correspond forcément à*:
une réaction d'ordre 0
une réaction d'ordre 1
une réaction d'ordre 2
une réaction de pseudo ordre 1
Encore ce genre de question que je ne sais pas comment répondre....
20. L'unité de la vitesse de réaction est*:
m / s
mol /s
s / m
M /s
L.s
REPONSE 4 en mol/l/s
21. Caractéristiques de la spectrophotométrie.
La spectrophotométrie est une technique d'analyse qui repose sur l'absorption de la lumière par les espèces chimiques.
Un spectrophotomètre mesure la conductivité d'une solution.
Lorsqu'on suit une transformation impliquant une espèce chimique B par spectrophotométrie, il faut régler la longueur d'onde du spectrophotomètre sur une valeur qui correspond à un maximum d'absorption de l'espèce B afin d'avoir le maximum de sensibilité.
La spectrophotométrie détruit les espèces impliquées dans la transformation chimique.
REPONSE 1 ET 3
22. KA*et pKA*d'un couple acide/base.
L'expression du KA*d'un couple acide/base A/B est Qr*= (A)(H30+) / (B).
L'expression du KA*d'un couple acide/base A/B est Qr*= (B)(H30+) / (A).
KA*s'appelle la constante d'acidité du couple A/B.
pKA*= -log KA
La constante d'équilibre de la réaction A(aq) + H2O(l) = B(aq) + H3O+(aq) est KA*.
REPONSE 2, 3 ET 4.
Voilà!! Merci beaucoup
-----