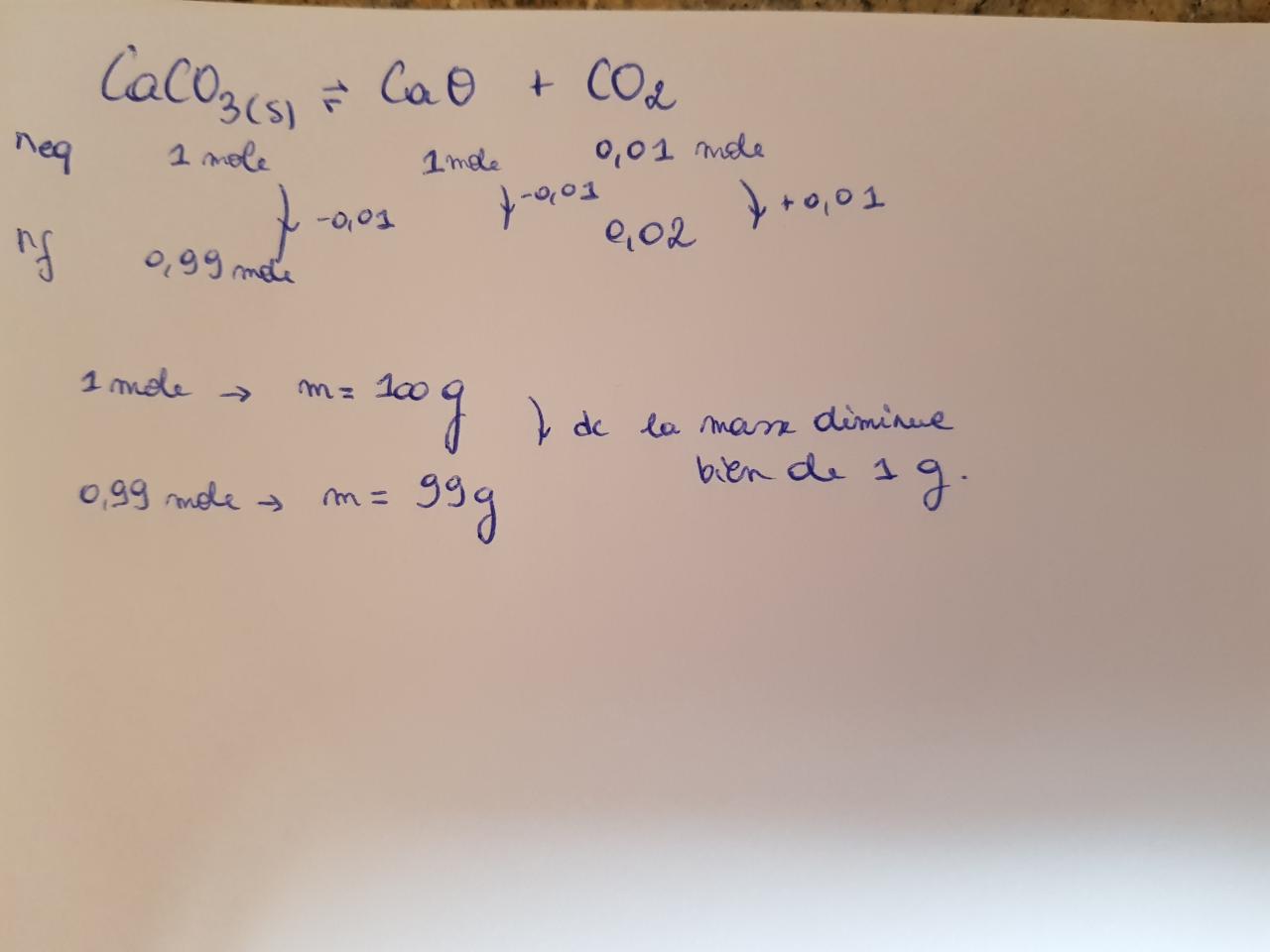Bonjour,
Voici une équation :
CaCO3(s) = CaO(s) + CO2(g) dans 1L et 100°k et 0,082 atm
Lorsque le volume double pourquoi la masse de carbonate de calcium diminue de 1g ?
Voici mon raisonnement :
J'avais trouvé la concentration de CO2
à l'équilibre (0,01M) dc le nombre de mole = 0,01
Pour les solides c'est 1M
Si V double déplacement de l'équilibre à droite
Et comme concentration de CO2 ne change pas alors le nombre de mole devient 0,02 mole
Pour CaCO3 n= 2 mole
CaCO3 -> CaO + CO2
Après je suis bloqué savez-vous m'aider ???
-----