Bonjour,
J'ai un peu de mal avec mon exercice, pouvez vous me conseiller s'il vous plait ?
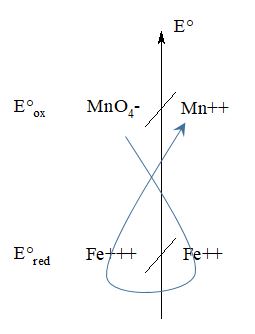
Je vous joint l'énoncé, les données et la correction de mon exercice.
En fait, je me demande pourquoi on a du faire tous ces longs calculs (encadré en bleu). Pourquoi ne pas utiliser directement la formule et la ligne de calcul en rouge ?
De plus, je me demande comment identifier E1 et E2. Comment savoir "qui est qui" ?
Merci de votre attention
1 pièce jointe :

-----