Bonjour,
Comme critère de spontanéité thermodynamique d'une réaction chimique, on établit que la variation d'enthalpie libre doit être négative.
Dans la pratique des exercices, on utilise en fait toujours l'enthalpie libre de réaction (standard ou pas). Quelle en est la raison ?
Je suppose que la variation de G n'est pas accessible à l'expérience (à part peut-être pour les piles) et que, du coup, on est obligé d'utiliser les tables thermodynamiques des grandeurs standard.
Merci d'avance pour vos réponses.
-----



 et non pas la variation d'enthalpie libre
et non pas la variation d'enthalpie libre 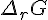 , autrement dit la pente de la courbe G=f(ξ) pour un avancement donné, le critère précédent équivaut à une pente négative.
, autrement dit la pente de la courbe G=f(ξ) pour un avancement donné, le critère précédent équivaut à une pente négative.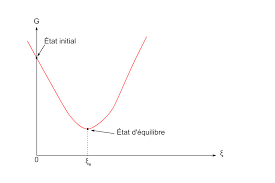
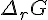 que l'on va toujours utiliser via la relation avec le quotient réactionnel Q et l'enthalpie libre standard de réaction.
que l'on va toujours utiliser via la relation avec le quotient réactionnel Q et l'enthalpie libre standard de réaction.