Bonjour,
Je bloque sur cet exercice depuis un moment maintenant, surtout sur la partie de la courbe !
H2CO3 est un diacide caractérisé par pKA1 = 6,4 et pKA2 = 10,3
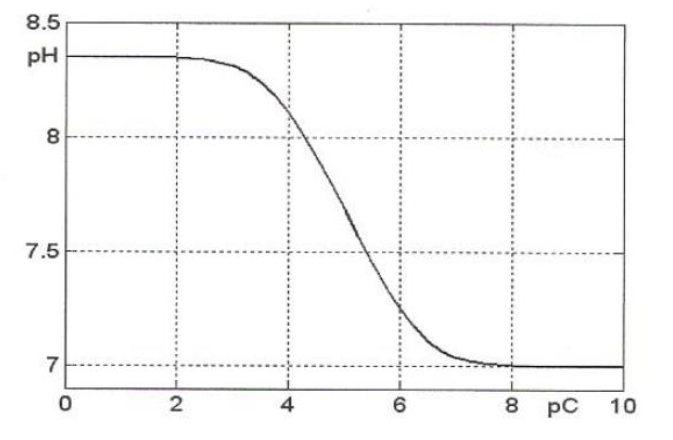
Calculez le pH d'une solution de NaHCO3 à C = 0,1 mol/L puis commentez le graphe donnant
l'évolution du pH d'une solution de NaHCO3 en fonction de pC = - log C (avec C= [HCO3-])
Après démonstration, on trouve un pH à 8,35.
J'aimerais démontrer par le calcul que l'on peut négliger l'hydrolyse de HCO3- à partir de [HCO3-] <= 10^-3 (donc pC= 3).
J'ai commencé de cette façon:
Hydrolyse de HCO3- : HCO3- + H2O -> CO32- + H3O+
On cherche la concentration [HCO3-] à partir de laquelle on ne peut plus négliger l'hydrolyse de HCO3-
Ainsi on cherche donc à résoudre:
[H3O+] >= [HCO3-] x 10
J'aimerais donc savoir si je suis sur la bonne voie pour justifier l'allure de la courbe et si c'est le cas, quelle concentration de H3O+ dois je utiliser pour résoudre cette équation ?
Merci par avance de vos réponses !
-----



