Bonjour,
Je n'arrive pas a résoudre cet exercice. Quelqu'un pourrait s'il vous plaît m'expliquer comment le résoudre ? Merci beaucoup
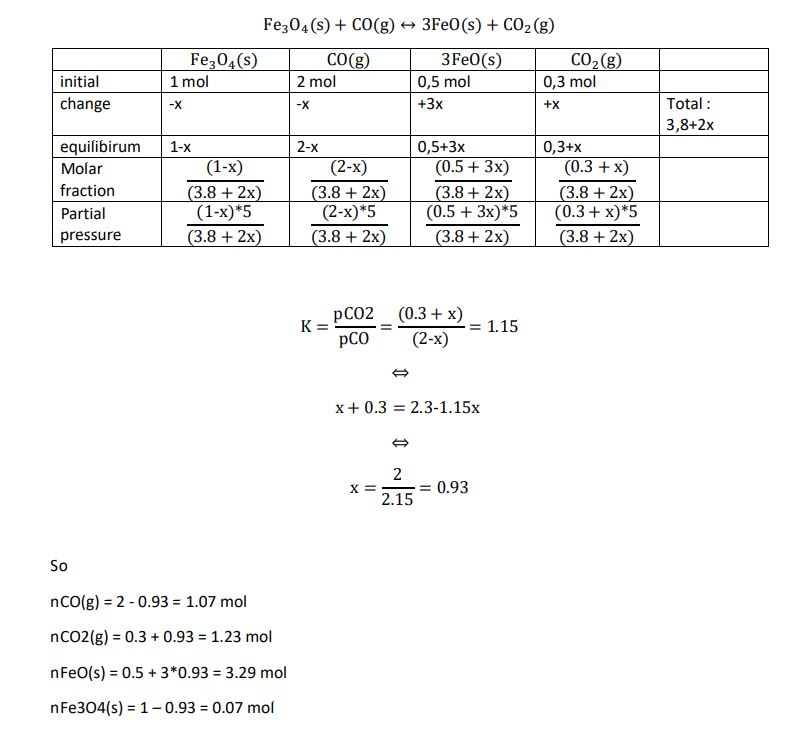
La constante d’équilibre à 600 °C pour la réaction
Fe3O4 (s) + CO (g) ↔ 3FeO (s) + CO2 (g)
est égale à 1.15.
Si un mélange initial consistant de 1 mol de Fe3O4, 2 mol de CO, 0.5 mol de FeO et 0.3 mol of
CO2 est chauffé à 600°C à une pression totale constante de 5 atm, calculer la composition du
mélange à l’équilibre.
-----