Bonjour,
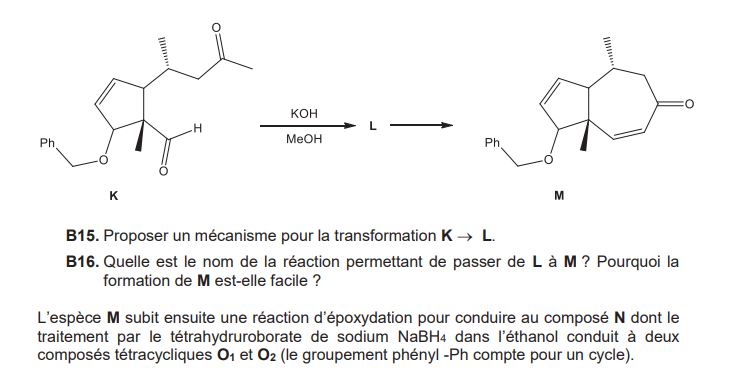
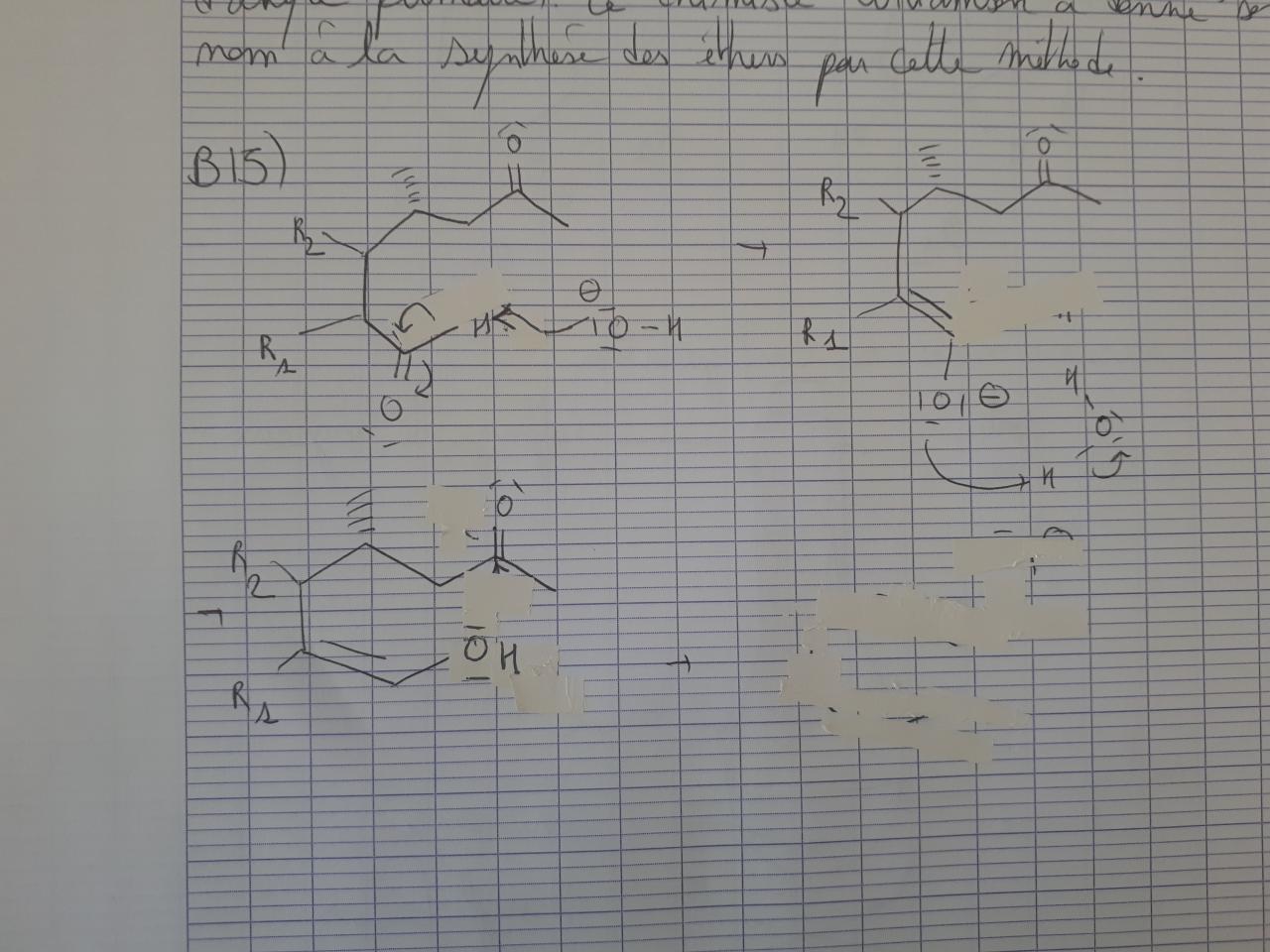
Je réfléchis à la synthèse décrite ci jointe mais je ne vois pas trop comment me "débarasser" d'un des groupements carbonyle pour former le composé M. J'ai essayé une attaque nucléophile de HO- sur le carbonyle du bas mais je ne vois pas trop en quoi ça m'avance pour la suite. Pour ce qui est de la formation du composé M, je pense à l'énolisation. Il s'obtient facilement parce qu'il s'agit d'un équilibre entre les deux formes tautomères cétone et énol. Mais là encore je ne vois pas trop comment on a fait pour la cyclisation de la molécule.
Voici l'énoncé en question :
Merci !
-----