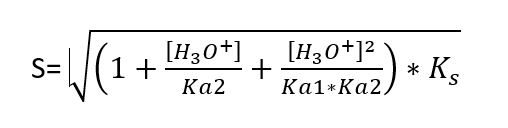Bonsoir,
On me demande de calculer la solubilité du MnS a pH = 5
Apres tout les calcules j'obtient
Avec:
Ks=2.5 *10^-13
Ka1= 9.6*10^-8
ka2= 1.3*10^-14
Mon résultat final es s= 0.142 mol/L
Le problème c'est que mon résultat est éloignée du résultat de mon prof (lui il nous donne seulement le résultat est pas la méthode). Est-ce que quelqu'un peut me dire où est-ce que je me trompe svp. Son résultat a lui est de s = 4,6.10-4 mol/l
Un grand merci d'avance
-----