Bonjour voici un exercice :
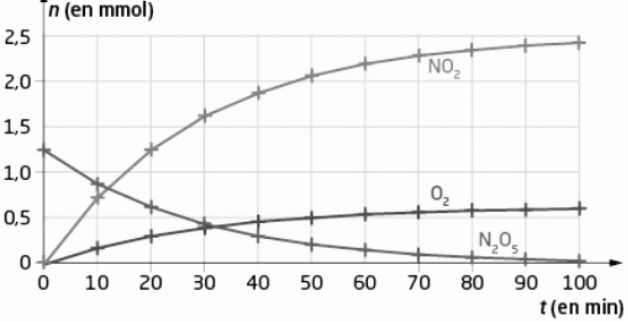
La figure suivante représente l'évolution des quantités de matière dans une enceinte fermée de volume constant V=1,0 L et à température constante (T= 350 K) lors de la décomposition du pentoxyde de diazote modélisée par la réaction d'équation:
N205(g)->2N02(g)+ 1/2 O2(g)
DONNÉES : L'équation d'état des gaz parfait s'écrit PxV=nxRxT avec P pression totale en Pa; V volume de l'enceinte en m3 R=8.31|.mol-1.K-1: T la température du milieu en K et n la quantité de matière totale d'espèces gazeuses en mol.
a. Justifier que l'évolution temporelle du système peut
être suivie à l'aide d'un capteur de pression.
b. Déterminer si la transformation est totale ou non totale.
c. Mesurer la vitesse volumique initiale de formation du
dioxygène et celle du dioxyde d'azote NO2 Commenter.
d. Déterminer le temps de demi-réaction t1/2 pour chacune
des concentrations en quantité de matière initiales
suivantes (en mmol-L-]): 1,24; 0,92; 0,68 et 0,50. Conclure.
e. Prévoir la valeur de la concentration en quantité de
pentaoxyde de diazote [N,O;] à la date t=6 x t1/2.
On nous demande quelques questions de généralité, puis on remarque que la vitesse de formation des produits est proportionnelle à leur coefficients stchiométriques : on fait alors l'hypothèse une réaction d'ordre 1 mais il vient ensuite pour confirmer l'hypothèse, la question suivante : déterminer le t1/2 à déférentes concentrations initiales, et conclure.
Donc on attend à avoir un t1/2 ne dépendant pas de C0 or je ne vois pas comment exprimer le temps sans se servir de l'hypothèse de l'ordre 1 de la réaction.
J'ai trouvé que P(t1/2) = 5/4 P0 mais comment exprimer le temps vu qu'on a ni l'avancement en fonction du temps ni la pression en fonction du temps?
-----


