Bonjour
Je commence un nouveau TP pourriez-vous me donner votre avis sur les réponses apportées dont voici le sujet.
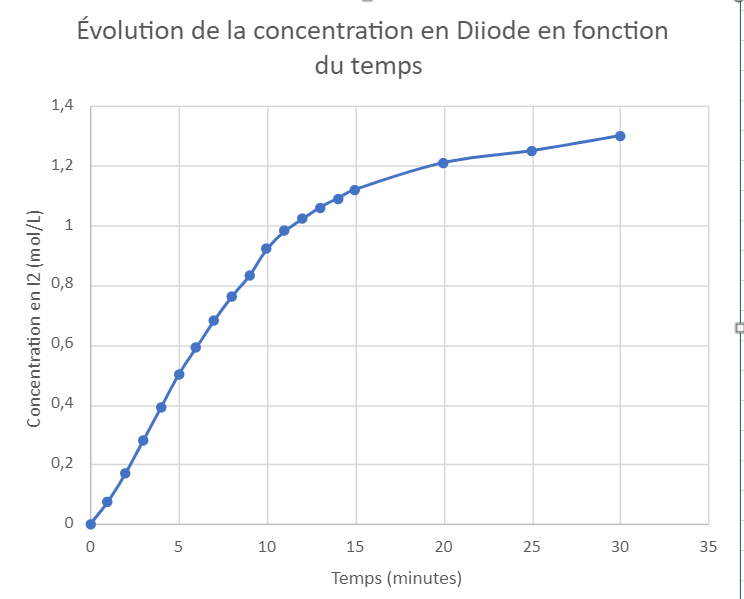
TP cinétique chimique.pdf
a. Les deux espèces en présences sont iodure de potassium et le peroxodisulfate de potassium
b. I2 + 2 e- = 2 I-
S2O82- + 2 e- = 2 SO42-
c.L’équation de la réaction est donc : 2 I- + S2O82- = I2 + 2 SO42-
d. les ions potassium K+ sont spectateurs
e.une solution diiode est de couleur jaune car elle absorbe principalement dans le violet (entre 400 et 424 nm) est-ce que cette justification est suffisante!!
f.Le spectrophotomètre doit être réglé sur la longueur d’onde correspondant au maximum
d’absorption, soit ici, par lecture graphique sur le spectre d’absorption,
max = 4,7102 nm.
A réalisation d'une courbe d'étalonnage
N° des solutions de diiode 0 (mère) 1 2 3 4
concentration (mol.L−1) 5, 0 × 10−3 // 2, 5 × 10−3 // 1, 0 × 10−3 // 5, 0 × 10−4 // 0
Volume mère (mL) 0,01 // 0,005 // 0,0025 // 0,00125 // 0
Volume fille (mL) 10 // 10 // 10 // 10
Absorbance A
Je ne trouve pas la relation pour calculer l'absorbance est-ce que mon tableau et mes données jusqu'à là sont correctes.
-----