Bonjour ! J'espère que vous vous portez à merveille
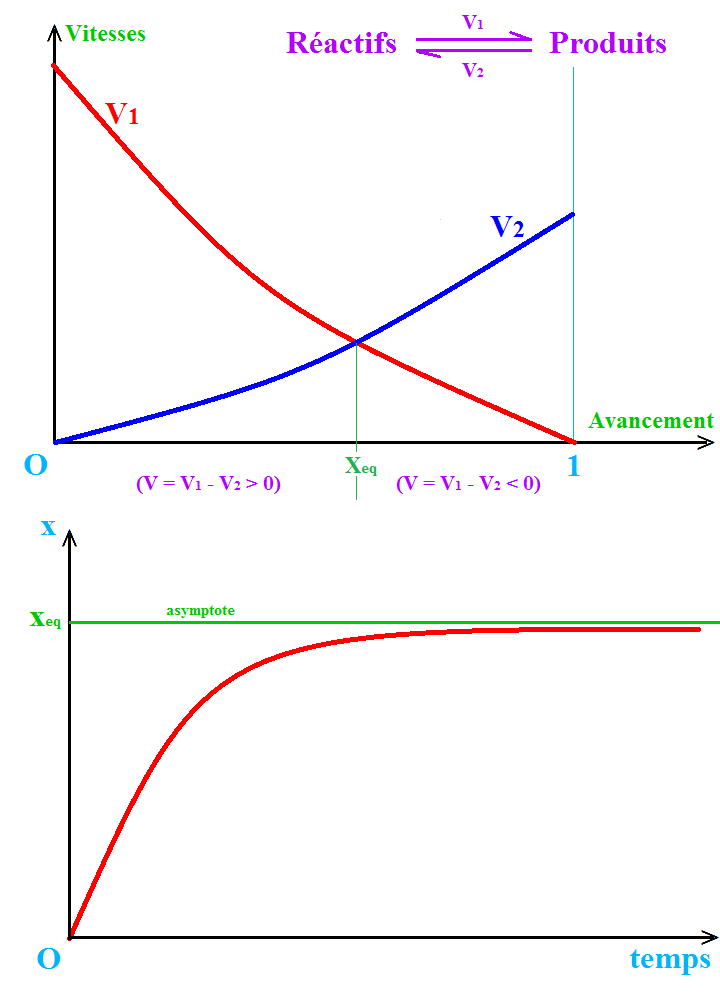
Aujourd'hui, mes questions se portent sur l'équilibre chimique ! J'ai récemment appris qu'il existe certaines réactions qui se déroulent en même temps dans les deux sens, et qui finalement atteignent l'équilibre, où les quantités des produits et réactifs demeurent inchangées mais que la réaction se déroule toujours, dans les deux sens, mais cette fois-ci à la même vitesse (d'où le fait que les quantités des réactifs/produits ne changent plus).
Celà étant, si avant d'atteindre l'équilibre, la réaction se déroule dans les deux sens, dans ce cas, comment ça se fait qu'elle évolue de façon à ce que la quantité des produits augmente et que celle des réactifs diminue ? Est-ce que ça entendrait que la réaction dans un des deux sens est plus rapide que dans l'autre ? J'ai également appris une notion dite "degré de conversion d'un réactif" et c'est la quantité de matière du produit à l'équilibre sur la quantité de matière du produit que l'on aurait obtenu si la réaction était complète. Mais je me demande ; à quoi ça pourrait bien nous servir, cette notion ? 樂
Et merci infiniment à tous ceux qui répondront ! <3
-----