Bonjour, j'ai une interrogation concernant la présence de force de Debye (induction) et force de London (dispersion) dans l'eau.
J'ai du mal à saisir pourquoi il y aurait d'autres forces intermoléculaires que la force de Keesom (orientation) sous forme de pont-H, étant donnée que chacun des atomes composant la molécule sont polarisés, j'ai du mal à voir où sont les dipôles instantanés/induits inhérents à ces deux interactions intermoléculaires
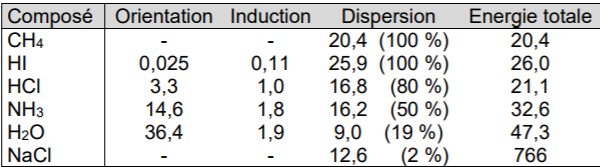
L'image montre la répartition des différentes interactions dans différentes substances.
Comment se manifestent ces deux interactions dans l'eau?
-----


