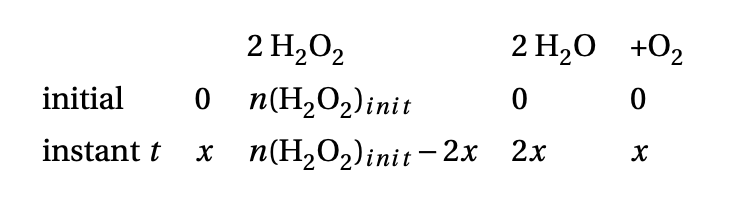Bonjour,
Je bloque dès le premier exercice quelqu'un peut-il m'aider?
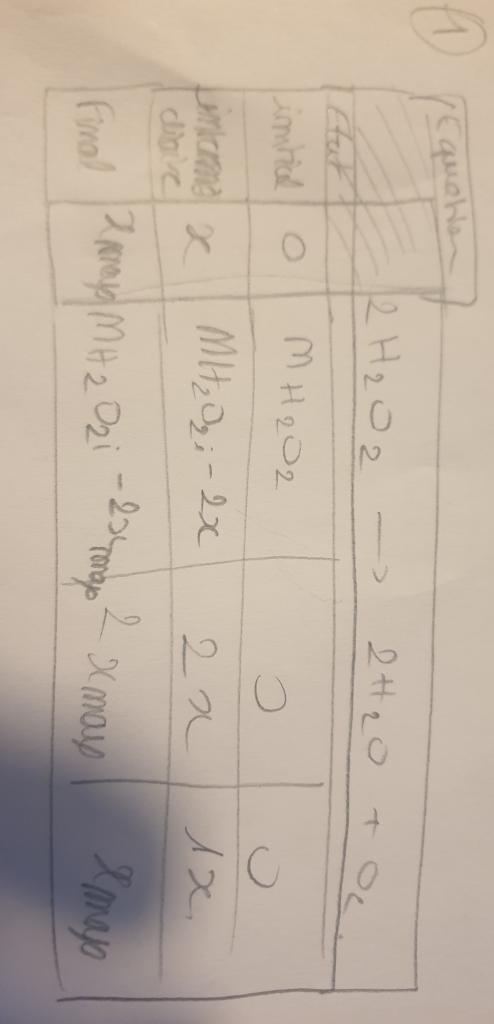
Dans l'exercice 1 je n'arrive pas à calculer la quantité n(O2) mol je pensais utiliser la formule n=CxV mais je n'ai pas la concentration d'O2
Je pense qu'il faut que j'utilise l'énoncé avec la réaction et que 2 mol de H2O2 donne 2 mol de H2O et 1/2 mol de O2
Voici l'énoncéFiche exo cinétique.pdf
Qui pourrait me donner une explication?
En vous remerciant par avance de votre aide
-----