Bien le bonjour, je me questionnais au sujet de l'équation de Clausius-Clapeyron :
Qui permet de calculer une température d'ébullition pour une pression donnée. On peut ici effectuer rapidement un calcul : https://www.123calculus.com/point-eb...-9-60-400.html . Si je prends l'exemple du fer, que je veux calculer sa température d'ébullition dans le milieu interstellaire : pression d'un femtopascal (10^-15) https://fr.m.wikipedia.org/wiki/Ordr...ur_de_pression , j'obtiens mon résultat. (Apparemment en milieu interstellaire il est question d'un atome par cm3 (10^-15 ou 10^-14 pascals)).
Mes questions sont : est-ce qu'il y a plus petite pression que cela ? Par exemple un proton, neutron, électron, quark par cm3 ? Ou m3 ? Si je veux enlever le dernier atome restant du cm3, et donc avoir la température d'ébullition dans le vide absolu (pression 0) comment calculer cela vu que ça marche pour un atome donc 10^-15 pascals (P2 dans la formule), mais que si on met 0 ça ne marche plus ? Est-il impossible de calculer cela ?
J'ai pensé à calculer donc pour 1x10^-15 pour le fer si on note point d'ébullition 2861°C à une pression de 101 325 pascals et enthalpie de vaporisation de 349600J/mol, ce qui donne température d'ébullition 433.75525390901°C, puis 2x10^-15 (2 atomes par cm3) donnant 442.09017227621°C, on voit donc qu'en passant d'un atome à deux atomes par cm3 on gagne environ 8.4°C (arrondi), mais si on ajoute un troisième atome, donc 3x10^-15 on passe à 447.05753447434°C, cette fois-ci on ne gagne que 5°C. Ce n'est donc pas constant. Si je veux enlever le dernier atome par calcul en reportant mes résultats, si je fais de 2 atomes à 1 atome (donc enlever 8.4°C, 442.09017227621°C - 8.4°C arrondi), je retrouve ma température de 433.75525390901°C pour un atome, j'enlève à nouveau 8.4°C j'aurais théoriquement le résultat (du moins environ) pour une pression de 0 (vide absolu) ? Environ car vu que de 1 à 2 atomes on gagne 8.4°C mais que de 2 à 3 on gagne 5°C (et ainsi de suite, pour 4x10^-15 on a 450.62398504431°C soit de 3 à 4 atomes un gain d'environ 3.6°C). Ma question est vraiment sur le dernier atome restant pour avoir un résultat pour une pression de 0 (vide absolu).
J'espère avoir été aussi clair que possible, d'avance merci à vous tous pour vos réponses !
Bonne fin d'après-midi à tout le monde et bon week-end !
-----



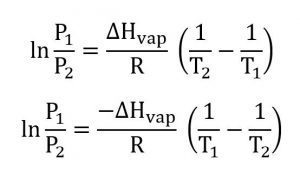
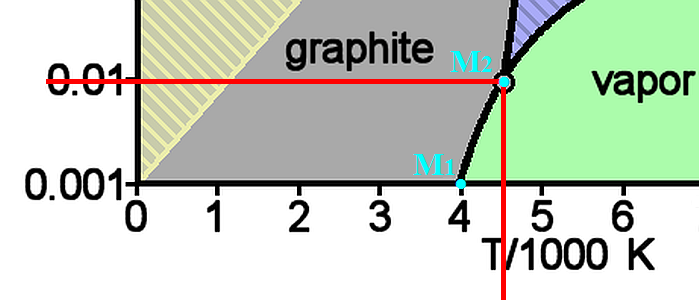
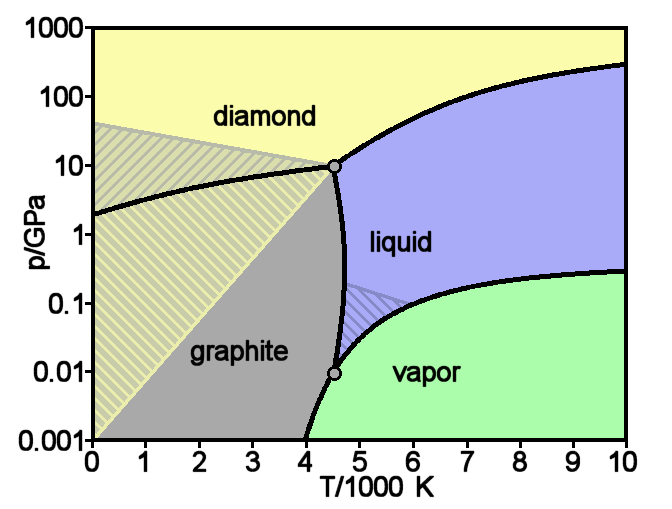 quand je vois ce diagramme de phase du carbone j'ai du mal à imaginer qu'il descende jusqu'à 0 car il y a quand même une bonne marge, non ?
quand je vois ce diagramme de phase du carbone j'ai du mal à imaginer qu'il descende jusqu'à 0 car il y a quand même une bonne marge, non ?