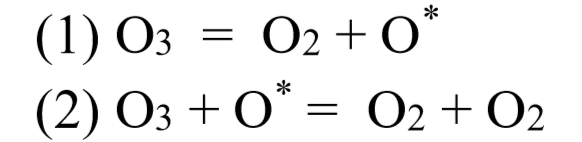Bonjour,
J'ai beaucoup de mal à distinguer certains concepts:
1. Est-il possible de reconnaitre à la forme de la(/les) réaction(s) une réaction dans laquelle se produit un complexe activité d'une réaction dans laquelle se produit un intermédiaire réactionnel ? (sans calculs faisant appel aux données des composants de la réaction donc)
2. Peut-on utiliser l'hypothèse de quasi stationnarités et donc calculer une constante de pseudo-équilibre dans les 2 cas de figures mentionnés à la question précédente?
3. Est-ce que toute réaction avec réactif intermédiaire est appelée réaction en chaine ? Ou bien faut-il une répétition de l'étape de propagation (un bouclage répéter d'un cycle à ce niveau) afin d'appeler celà un réaction en chaine ? Ou encore y a-t-il une autre distinction possible à faire entre certaines réactions dans laquelle il y a un intermédiaire réactionnel mais pas réaction en chaine, de celle ou il y a réaction en chaine?
4. La réaction en chaine radicalaire est un cas spécial de réaction en chaine, correct ? Mais je reste confu sur cette nuance (nous n'avons pas défini le concept de radical dans notre cours...), aussi, l'asterisque utilisée dans la notation des radicaux est elle bien propre à ceux-ci, ou dénote-t-elle un concept plus général? (celà non plus n'a pas été défini dans notre cours...).
5. Enfin, peut-on parler de radicaux en dehors du cadre des réactions en chaine radicalaires (j'ai vu le terme employé dans un ancien examen de mon cours dans lequel il n'y avait que 2 étapes élémentaires et non pas initiation, propagation et terminaison; mais je ne vois ça a aucun endroit dans mon cours de ce jour, d'ou ma confusion)
Cordialement,
-----