Bonjour à tous,
Je suis présentement étudiant en dernière année de sciences de la nature et, dans le cadre d'un cours de chimie pharmaceutique, je dois expliquer la synthèse et les mécanismes réactionnels d'un médicament. J'ai choisi l’acyclovir. Je m'interroge sur certaines choses et je me dis que peut-être quelqu'un ici saura m'éclairer.
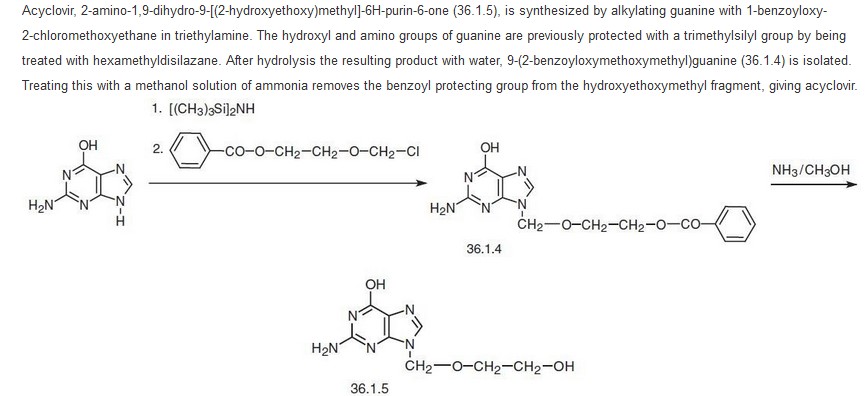
Tout d'abord, j'ai réussi à trouver la réaction globale de la synthèse.
1
Le mécanisme de protection des fonctions amines et hydroxyle se fait à l'aide de HMDS (ce que je ne peux pas expliquer avec mes connaissances actuelles). Jusque là, il a été convenu avec mon professeur que je ne suis pas obligé de l'expliquer. Viens ensuite le mécanisme de la seconde étape, c'est à dire l'alkylation de la guanine.
Mon hypothèse étant que la Triéthylamine utilisée comme base irait déprotonner l'hydrogène de l'azote sur l'imidazole, et ensuite le carbone de la chaîne benzylé qui se retrouve entre le O et le CL, étant très électrophile, va aller se lié avec le doublet de l'azote qui a perdu son H.
Or, mon professeur me dit que ce serait plutôt l'alkylation en premier, comme dans une synthèse de Hoffmann, et le N étant devenu N+ perdrait son H au profit de la Triéthylamine par la suite.
Je me demandais si quelqu'un ici aurait une petite piste de solution
Merci beaucoup
LD
1 https://www.guidechem.com/encycloped...-dic25319.html
-----