Bonjour tout le monde ,
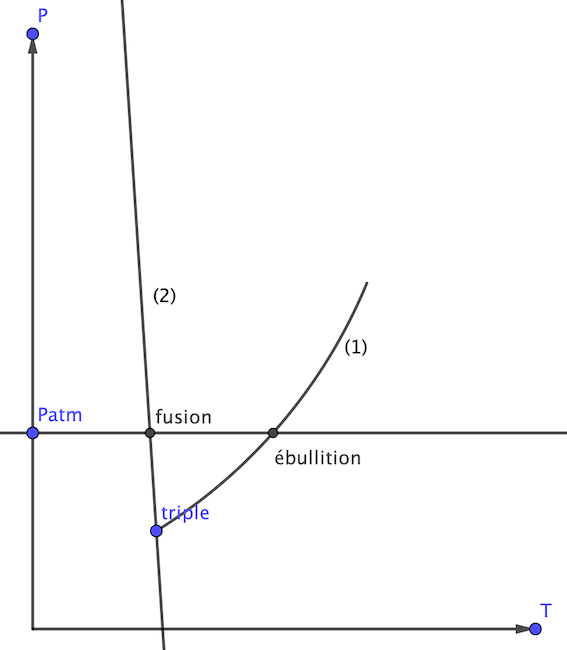
Alors voici mon énoncé et j’ai du mal à calculer les coordonnées du point triple.
Normalement on a les données du point critique et c’est plu simple ensuite mais là on les a pas et je ne sais pas comment faire.
A l'aide des données ci-dessous concernant le corps pur Zn :
a) Etablir la relation entre LnPs et T (forme –A/T +B) pour l'équilibre liquide-vapeur avec Ps en bar. b) Préciser les coordonnées du point triple dans le repère P-T.
c) Calculer les pentes des courbes de vaporisation et de sublimation au voisinage du point triple.
Données:
Chaleur latente de vaporisation : 114.8 kJ/mol;
Chaleur latente de fusion : Lf = 6.67 kJ/mol ;
Température de fusion : Tf = 419.6 °C;
Température d'ébullition: Teb = 907°C (sous P =1.013 bar) pente de la courbe de fusion au point triple : 145.86 bar/K Masse molaire 65.409 g/mol ; Densité du solide : 7.14
-----