Bonjour à toutes et à tous, voilà deux jours que je lis les sujets concernant l'acidification par l'acide citrique mais je me retrouve face à un problème que je n'arrive pas malgré mes calculs à résoudre alors je vais tenter de vous l'exposer pour d'abord essayer de comprendre ce que je ne calcule pas bien mais aussi je l'espère au final avoir une réponse.
Alors en partant des éléments suivant : 5 L d'un mélange contenant de l'eau du robinet et 4 jus de citron avec un pH du mélange à 3.5.
En partant de ces informations et ne disposant pas de la quantité de jus qui a été additionnée je suis parti de données généralistes sur les citrons et d'autres plus informelles sur l'acide citrique qui pour l'exercice sera considéré comme un acide faible de pKa 3.11.
Alors, 1 citron pèse en moyenne 90g dont 90% d'eau et une teneur en acide citrique de 8% de la matière sèche :
Cela nous donne 90x0,1x0,08=0,72g d'acide citrique dans 1 citron.
On peut tirer environ 60mL de jus d'un citron soit 0,06L. Si l'on considère la densité du jus de citron à 1 (on n'en ait pas loin je crois), dans mes 60mL de jus de citron j'aurais donc 0,6x0,72=0,432 g d'acide citrique.
Le jus de 4 citrons nous font donc 0,24 L et 1,728 g d'acide citrique.
La masse molaire de l'acide citrique est de 192,184 g.mol donc 1,728/192,184=0,009 moles d'acide citrique.
Dans les 5L de mélange on a donc une teneur en acide citrique de 4,8%.
On sait que 0,001 moles/L d'acide citrique (0,192g) avec un pKA de 3.11 nous donne un pH de 3.06.
Donc nos 0,009 moles d'acides citriques diluées dans les 5L ou même 4,76L nous donnerait 0,0018 mol/L soit un pH de 2,92.
Si je ne vous ai pas perdus jusque là merci de me dire si mes calculs sont corrects
Allons sur la suite.... Je me retrouve avec un pH de 3.5 et non 2,92. Cela peut venir de mes approximations mais à en croire certaines épreuves de bac que j'ai pu croiser la teneur d'un citron serait un peu plus élevée de l'ordre de 0,013g d'acide citrique et si finalement le jus d'un citron ne fait que 50mL je me retrouve avec un pH de 2,97 selon les calculs, enfin toujours proche de 3.
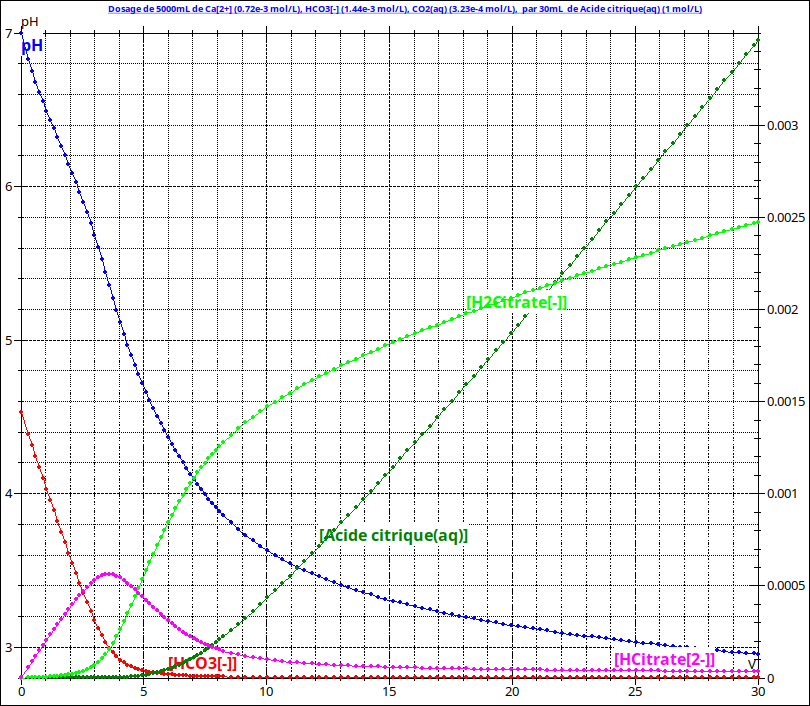
Mon eau de robinet est à pH 7 mais elle a quand même un pouvoir tampon avec ses Hydrogénocarbonates (88ppm), seraient-ce les responsables ?
Une fois que j'aurais éclairci cela sachant que j'ai aussi réalisé les calculs en partant d'autres informations comme une teneur en acide citrique de 47g.L de jus de citron (Là en comptant 20 citrons, 50ml de jus par citron on est loin du compte donc cette donnée semble fausse ou c'est moi), j'ai un autre problème à soulever et je manque d'informations, je n'arrive pas à trouver de solution :
(Vous me direz le premier problème n'y change rien mais j'ai envie de comprendre).
Je me retrouve donc avec mes 5L de mélange avec un pH de 3.5 et je souhaite avoir les mêmes 5L mais à un pH de 3. Je peux donc ajouter de l'acide citrique anhydre de même masse molaire pour obtenir mon pH mais je n'arrive pas à calculer simplement la quantité nécessaire.
On va avoir pour mon mélange un pH de 3.5 avec un volume connu et une concentration en acide citrique inconnue et on a de l'autre côté une concentration connue et un volume a déterminer, je suis sur la bonne voie où je me fourvoie quant au calcul à venir ?
Je vous remercie sincèrement pour l'aide que vous pourrez m'apporter, je bute un peu sur l'ensemble avec des connaissances acquises et les réflex qui vont avec mais ce n'est plus de première fraicheur et je n'ai pas envie d'en référer à une IA
Merci encore, bonne journée à vous.
(j'ai eu le réflex de copie ce long message avant de le valider et me retrouver en "non connecté"... OUF)
-----




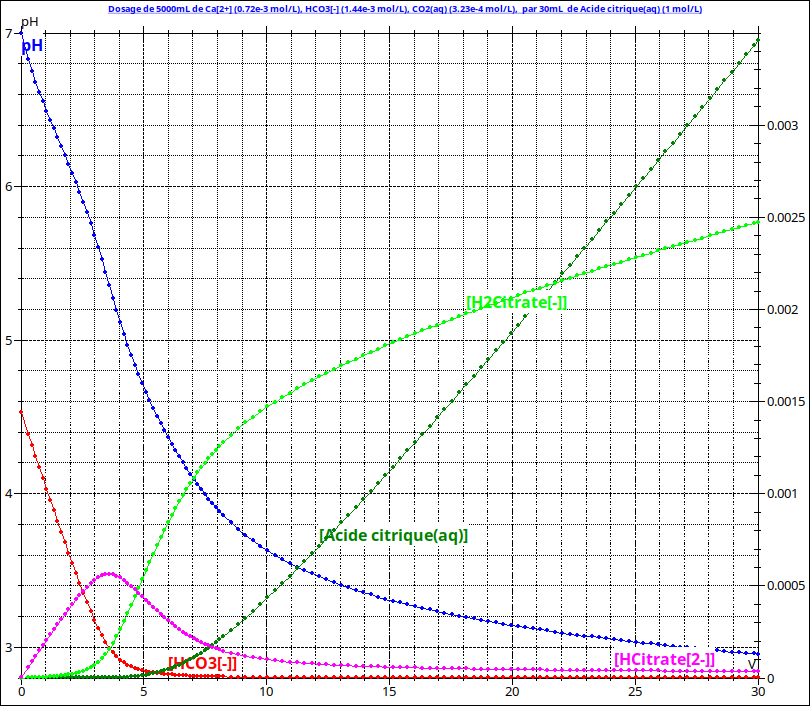
 (correspondant à une concentration massique de 88mg/L)
(correspondant à une concentration massique de 88mg/L)