Bonjour,
J'aimerai avoir votre avis sur une eventuelle possibilité d'eviter la formation de goudrons dans un gazeifieur de biomasse.
Pour résumer la situation, le bois est chauffé et à partir de 300-500°c le bois subit des transformations chimiques via water–gas shift reaction (WGSR) ou une "réaction du gaz à l'eau".
De façon generale on aimerait bien faire un produit final de sortie utile, comme un carburant avec des exigences de pureté.
Il ya le procedé à basse temperature, qui genere moins de gaz incondensables, des condensables, des goudrons et du charbon. Le goudron fini par tout boucher et il faut distiller tout les gaz condensables.
Il ya le procedé haute temperature avec un temps de sejour le plus court possible pour eviter les reconbinaisons qui donne les condensables et le goudron et une fois obtenu CO et H2 on passe à la synthese d'un produit souhaité avec des catalyseurs specifiques.
Equilibrium-composition-of-the-RWGSR-and-CO2-methanation-CO2H2-11.png
Ce qui me chiffone c'est que j'arrive pas à comprendre pourquoi personne n'essaient de reduire la proportion H2 dans le reacteur avec des oxydes reductibles. On sait que l'oxyde de fer peut etre reduit par H2 par exemple.
Fe3O4 est meme un catalyseur bien connu pour sortir le gaz de synthese CO H2 et d'ailleurs on evite les conditions de sa reduction.
Pourtant si on reduit la pression partielle H2 avec des oxydes metaliques, mais surtout d'apres mon imagination, on devrait eviter la formation des goudrons et condensables exotiques qui sont tous hydrogenés dans leur formulation.
Alors pourquoi personne ne fabrique les oxydes metaliques en premier lieu avec de la vapeur d'eau pour isoler H2 à cette etape? Une fois les oxydes ajoutés et melangés au bois, direction le reacteur de gazeification pour isoler CO2 et H2O du CO utile.
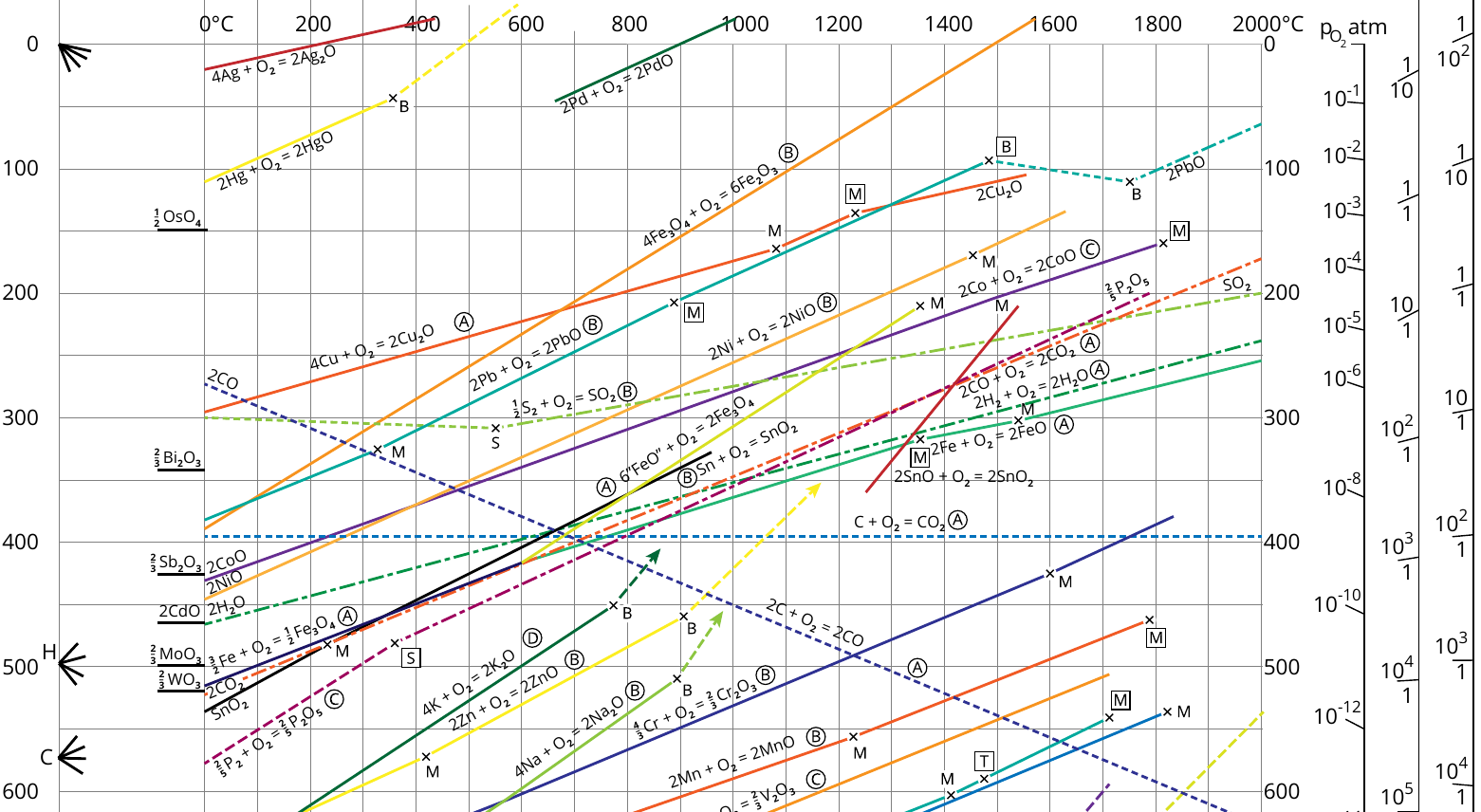
Evidement pour illustrer le propos j'ai pris l'exemple de l'oxyde de fer, comme transporteur d'oxygene car c'est connu et il ya de la documentation bien fournie sur les equilibres thermodynamiques de reduction.
ironReductionAtmosphere.png
En pratique je prefere utiliser un metal à bas point de fusion, comme l'etain voir le bismuth dont les oxides pourait avoir le meme role : generer en amont l'hydrogene et dans le reacteur de gazeification reduire la pression partielle H2 via la reduction des oxides SnO2 ou Bi2O3. Une fois reduit, le metal liquide est recuperé avec plus de facilité qu'un fer non liquide.
L'etain est tres proche du fer thermodynamiquement, si on regarde un diagramme d'ellingham.
Bi2O3 est assez seduisant puisque son oxydation par la vapeur d'eau est endothermique (consommer de l'energie electrique pour effacer une surproduction ENR momentanée, on peut faire un stock d'oxide et H2) et il est documenté que Bi2O3 est absorbant H2 à 500°c, notament pour eliminer H2 dans un caloporteur plomb bismuth.
La reduction de Bi2O3 par H2 doit etre exothermique dans le reacteur.
500-600°c c'est la temperature pour obtenir un water–gas shift reaction (WGSR).
Production H2 pure et sequestration carbonne facilité.
Bref je ne trouve pas le loup!
ps : j'igniore volontairement la methanation agricole, à 250e le mwh "thermique" ...
-----